题目内容
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
A
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式 ;D的电子式
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.A、B的化学式分别为 、 ;常温下,在A溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
A
| C |
| D |
其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.A、B的化学式分别为
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族H元素、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是乙炔;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,D是淡黄色固体,D为Na2O2,
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,A与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,则A为Na2CO3、B为NaHCO3;当碳酸钠与氯化氢按照1:1反应时,生成溶质为碳酸氢钠,溶液显示碱性,若为中性,则氯化氢应该稍过量,则中性时溶质为碳酸氢钠、氯化钠和碳酸.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是乙炔;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,C是溶于水显酸性的气体,C为CO2,D是淡黄色固体,D为Na2O2,
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,A与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,则A为Na2CO3、B为NaHCO3;当碳酸钠与氯化氢按照1:1反应时,生成溶质为碳酸氢钠,溶液显示碱性,若为中性,则氯化氢应该稍过量,则中性时溶质为碳酸氢钠、氯化钠和碳酸.
解答:
解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族元素、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是C2H2,
故答案为:C2H2;
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
B(在水溶液中进行),其中,C是溶于水显酸性的气体,则C为CO2,D是淡黄色固体则D为Na2O2,则:CO2的结构式为O=C=O,Na2O2的电子式为 ,
,
故答案为:O=C=O; ;
;
①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,甲与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,则A为Na2CO3、B为NaHCO3;常温下,在碳酸钠溶液中滴加稀盐酸至中性时,氢离子与碳酸根转化生成碳酸氢根,由于碳酸氢钠溶液仍为碱性,故氯化氢应该稍过量,部分碳酸氢根转化为碳酸、同时生成NaCl,则反应后的溶质的主要成分为:NaCl、NaHCO3、H2CO3,
故答案为:Na2CO3;NaHCO3;NaCl、NaHCO3、H2CO3.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(2)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是C2H2,
故答案为:C2H2;
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
| C |
| D |
 ,
,故答案为:O=C=O;
 ;
;①如果A、B均由三种元素组成,B为两性化合物,且不溶于水,则B为Al(OH)3,A为NaAlO2,甲与过量的CO2反应生成生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,则A为Na2CO3、B为NaHCO3;常温下,在碳酸钠溶液中滴加稀盐酸至中性时,氢离子与碳酸根转化生成碳酸氢根,由于碳酸氢钠溶液仍为碱性,故氯化氢应该稍过量,部分碳酸氢根转化为碳酸、同时生成NaCl,则反应后的溶质的主要成分为:NaCl、NaHCO3、H2CO3,
故答案为:Na2CO3;NaHCO3;NaCl、NaHCO3、H2CO3.
点评:本题考查了位置、结构与性质的关系,题目难度中等,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题知识点较多、综合性较强,充分考查学生灵活应用 基础知识的能力.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

| A、加入催化剂,不能改变该化学反应的反应热 |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、该反应的热化学方程式为:N2(g)+3H2(g)???2NH3(g),△H=-92 kJ/mol |
| D、在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
有机物的结构可用“键线式”简化表示.如:CH3---CH═CH---CH3可以简写为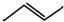 .有机物X的键线式为
.有机物X的键线式为 .下列说法不正确的是( )
.下列说法不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为 .下列说法不正确的是( )
.下列说法不正确的是( )| A、X的化学式为C8H8 |
B、有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式: |
| C、X能使酸性高锰酸钾溶液褪色 |
| D、X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |