题目内容
8.将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体560mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉m2 g,则(m1-m2)为( )| A. | 7.2 | B. | 2.4 | ||
| C. | 0 | D. | 缺少条件,无法计算 |
分析 铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,根据电子转移守恒计算参加反应的铜的物质的量,再根据铜元素守恒计算溶液中n[Cu(NO3)2],再向溶液中滴加足量稀硫酸至不再反应为止,容器剩有铜粉m2g,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,(m1-m2)为与溶液中NO3-反应的铜的质量.
解答 解:铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,生成Cu(NO3)2和NO气体,NO的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,根据电子转移守恒可知,参加反应的铜的物质的量为$\frac{0.025mol×(5-2)}{2}$=0.0375mol,根据铜元素守恒可知,溶液中n[Cu(NO3)2]=0.0375mol,溶液中n(NO3-)=0.0375mol×2=0.075mol.
再向溶液中滴加足量稀硫酸至不再反应为止,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,容器剩有铜粉m2g,(m1-m2)为与溶液中NO3-反应的铜的质量,令再次反应的铜的物质的量为xmol,则:
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 2
xmol 0.075mol
所以x=$\frac{0.075×3}{2}$=0.1125mol
所以再次反应的铜的质量为0.1125mol×64g/mol=7.2g,即(m1-m2)=7.2g.
故选:A.
点评 本题考查氧化还原反应的计算,难度中等,判断(m1-m2)为反应后溶液中与NO3-反应的铜的质量,注意根据电子转移守恒、元素守恒计算,如根据方程式计算,相对比较麻烦.

(1)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=akJ/mol
(2)2H2(g)+O2(g)═2H2O(l)△H2=bkJ/mol
(3)H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H3=ckJ/mol
下列关于它们的表述正确的是( )
| A. | 2c=b | B. | c=+285.8 | ||
| C. | 通过原电池可以实现反应(3) | D. | 氢气的燃烧热为a kJ/mol |
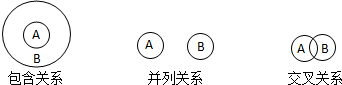
对下列概念的说法正确的是( )
| A. | 纯净物与混合物属于包含关系 | |
| B. | 胶体与分散系属于交叉关系 | |
| C. | 置换反应与离子反应属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
| A. | 酒精 | B. | 盐酸 | C. | 二氧化硫 | D. | 次氯酸 |
| A. | 用核磁共振氢谱不能鉴别1-丙醇和2-丙醇 | |
| B. | 实验证实 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | 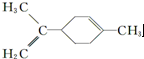 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. | 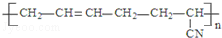 的单体是CH3-C≡C-CH3和CH2═CH-CN 的单体是CH3-C≡C-CH3和CH2═CH-CN |
| A. | 2mL | B. | 4mL | C. | 6mL | D. | 8mL |
| A. | 溶解度(25℃):小苏打<苏打 | B. | 沸点:H2Se>H2S>H2O | ||
| C. | 密度:溴乙烷>水 | D. | 碳碳键键长:乙烯<苯 |
| A. | 热稳定性:H2O>H2S | B. | 酸性:HCl>H2CO3 | ||
| C. | 金属性:K>Li | D. | 碱性:NaOH>Mg(OH)2 |
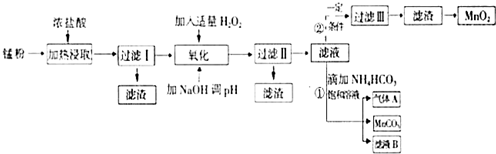 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).