题目内容
2.图1是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素F在周期表中的位置第三周期ⅣA族.
(2)DH其所含化学键类型为离子键.
(3)C、D、G对应的简单离子半径大小顺序是S2->O2->Na+.(用离子符号回答)
(4)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:
①溶液a和溶液b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子反应方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
分析 短周期元素中,A、F均有+4、-4价,处于ⅣA族,且原子序数A<F,故A为碳、F为Si;C、G均有-2价,且G有+6,G的原子序数较大,故C为O元素、G为S元素;B有+5、-3价,原子序数介于碳、氧之间,故B为N元素;H有+7、-1价,原子序数大于硫,则H为Cl;D有+1价,E有+3价,分别处于ⅠA族、ⅢA族,原子序数氧<D<E<Si,故D为Na,E为Al.
解答 解:短周期元素中,A、F均有+4、-4价,处于ⅣA族,且原子序数A<F,故A为碳、F为Si;C、G均有-2价,且G有+6,G的原子序数较大,故C为O元素、G为S元素;B有+5、-3价,原子序数介于碳、氧之间,故B为N元素;H有+7、-1价,原子序数大于硫,则H为Cl;D有+1价,E有+3价,分别处于ⅠA族、ⅢA族,原子序数氧<D<E<Si,故D为Na,E为Al.
(1)元素F为Si,在周期表中的位置:第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)DH为NaCl,其所含化学键类型为离子键,故答案为:离子键;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越小,简单离子半径大小顺序是:S2->O2->Na+,故答案为:S2->O2->Na+;
(4)利用最高价含氧酸的酸性强弱,证明A、B、F的非金属性强弱关系,溶液a为硝酸,溶液b为饱和NaHCO3溶液,溶液c为硅酸钠溶液,溶液c中的离子反应方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:①硝酸;饱和NaHCO3溶液;②SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子序数推断元素,注意对元素周期律的理解掌握.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| X | |
| Y | Z |
(2)Y原子的结构示意图为
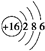 ,U2X的电子式
,U2X的电子式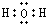
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.
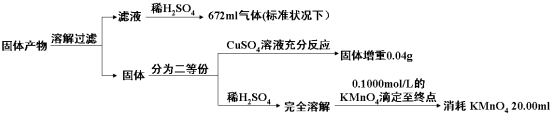
判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
| A. | 将某气体燃烧,在火焰的上方罩一个冷而干燥的烧杯,烧杯内壁有水珠生成,再将烧杯立即倒转并加入澄清石灰水溶液震荡,石灰水变浑浊,则该气体一定是烃 | |
| B. | 除去乙酸乙酯中少量的乙酸,用饱和的碳酸钠溶液洗涤,然后分液、干燥、蒸馏 | |
| C. | 1ml 1%的NaOH溶液中加入2ml 2%的CuSO4溶液,振荡后再加入0.5ml淀粉的水解液,加热后未出现砖红色沉淀,说明淀粉尚未水解 | |
| D. | 乙酸和乙醇的酯化反应实验中,向试管中加入试剂的顺序是:浓硫酸、乙醇、冰醋酸 |
| A. | 锌粒与稀硫酸反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 乙醇在氧气中燃烧 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
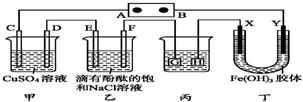 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.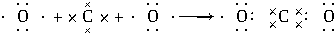 ,用电子式表示C、D两元素形成化学键的过程:
,用电子式表示C、D两元素形成化学键的过程: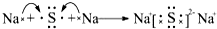 .
.