题目内容
4.下列有关化学用语使用不正确的是( )| A. | 硫离子的结构示意图: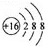 | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O2- | |
| C. | NH4Cl的电子式: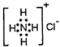 | |
| D. | 碘的外围电子排布:4s24p5 |
分析 A.硫离子的核电荷数为16,核外电子总数为18,最外层满足8电子稳定结构;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氯离子为阴离子,电子式中需要标出最外层电子;
D.碘原子在N能层含有7个电子.
解答 解:A.硫离子核外电子总数为18,其离子结构示意图为: ,故A正确;
,故A正确;
B.原子核内有10个中子的氧原子的质量数为18,其表示方法为:${\;}_{8}^{18}$O2-,故B正确;
C.氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为 ,故C错误;
,故C错误;
D.碘的最外层含有7个电子,其外围电子排布为:4s24p5,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、电子排布式、元素符号、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.苹果iPad、iPhone正在中国热卖,但137名苹果公司驻中国供应工厂的员工,却因长期暴露在正己烷环境中,健康遭受不利影响.某同学欲按沸点高低将正己烷插入表中(已知表中5种物质已按沸点由低到高顺序排列),则正己烷最可能插入的位置是( )
| ① | ② | ③ | ④ | ⑤ |
| 甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 辛烷 |
| A. | ②③之间 | B. | ③④之间 | C. | ⑤之后 | D. | ④⑤之间 |
15.据报道,放射性同位素${\;}_{53}^{131}$I 可以治疗肿瘤,该同位素原子核内的中子数为( )
| A. | 53 | B. | 78 | C. | 131 | D. | 125 |
12.下列有关放热反应、吸热反应的说法不正确的是( )
| A. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
19.下列离子方程式书写不正确的是( )
| A. | 向CuSO4溶液中加入铁粉:Fe+Cu2+═Cu+Fe2+ | |
| B. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 石灰乳与盐酸反应:H++OH-═H2O | |
| D. | 氯化镁溶液与氢氧化钠溶液反应:Mg2++2 OH-═Mg(OH)2↓ |
3.室温下,0.1mol/L的H2A溶液体系中,含A粒子的分布系数(平衡时某粒子的浓度占各粒子浓度之和的分数)与溶液 pH的关系如图所示.下列说法不正确的是( )


| A. | 室温下,HA-的电离常数Ka2=1.0×10-7 | |
| B. | 室温下,0.1mol/L的NaHA溶液显酸性 | |
| C. | 室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液pH=1.8 | |
| D. | 0.1mol/L的Na2A溶液中c(OH-)=c(H+)+c(HA-)+2c(H2A) |

 ;
; +2C2H5OH
+2C2H5OH
 +2H2O;
+2H2O; 、
、 .
.