题目内容
2.下列有关离子方程式正确的是 ( )| A. | 用Na2CO3溶液处理水垢中的不溶物:CaSO4(s)+CO${\;}_{3}^{2-}$(aq)=CaCO3(s)+SO${\;}_{4}^{2-}$ | |
| B. | 将Na2S溶液在空气中长期放置变浑浊:2S2-+O2+4H+=2S+2H2O | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-=CaCO3↓+2H2O | |
| D. | 向Fe(NO3)3溶液中通入过量SO2:2Fe3++SO2+2H2O=2Fe2++SO${\;}_{4}^{2-}$+4H+ |
分析 A.碳酸钙溶解性小于硫酸钙,实现沉淀的转化;
B.Na2S在空气中长期放置变浑浊,是硫离子的还原性被空气中的氧气氧化生成硫单质;
C.石灰水过量,反应生成碳酸钙、碳酸钠和水;
D.硝酸根离子在酸性环境下能够氧化二价铁离子和二氧化硫;
解答 解:A.用Na2CO3溶液处理水垢中的不溶物,离子方程式:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-,故A正确;
B.Na2S在空气中长期放置变浑浊,是硫离子的还原性被空气中的氧气氧化生成硫单质,2S2-+02+2H20=2S+40H-,故B错误;
C.向NaHCO3溶液中加入过量的澄清石灰水,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.向Fe(NO3)3溶液中通入过量SO2,离子方程式:NO3-+3Fe3++3SO2+4H2O═3Fe2++NO↑+3SO42-+8H+,故D错误;
故选:A.
点评 本题考查了离子方程式书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
12.关于一些重要化学概念的说法:①氢氧化钠的摩尔质量为40g/mol;②用酒精做萃取剂,提取碘水中的碘;③酸雨是指pH小于5.6的降水;④氧化还原反应的本质是反应前后元素的化合价变化;⑤丁达尔效应可以区分溶液和胶体;其中正确的是( )
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
13.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大,可以采用的措施是( )
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
10.分子式为C6H12O2并能与饱和NaHC03溶液反应放出气体的有机物(不考虑立体异构有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
17.若发现116号元素X,其不完整的原子结构示意图为 则下列预测正确的是( )
则下列预测正确的是( )
 则下列预测正确的是( )
则下列预测正确的是( )| A. | 该单质很难与其他物质发生反应 | B. | 其最高价氧化物的化学式为XO3 | ||
| C. | 第三层的电子数为8个 | D. | 元素X是一种非金属元素 |
5.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是BCD.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
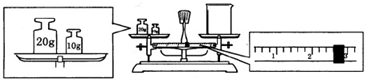
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图.则烧杯的实际质量为27.4g.
(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、250mL容量瓶.(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为检查是否漏水.
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的最浓度为0.084mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为BaCl2(填化学式).
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:④.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图.则烧杯的实际质量为27.4g.

(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、250mL容量瓶.(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为检查是否漏水.
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的最浓度为0.084mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为BaCl2(填化学式).
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:④.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
6.化学反应终点的判断是化学定量实验的重要环节.下列对化学反应终点的判断不正确的是( )
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |