题目内容
用如图下列实验装置进行的实验中,不能达到相应实验目的是( )

| A、用图①所示实验装置排空气法收集H2气体 |
| B、图②装置可以用来验证化学能转化为电能 |
| C、图③铁片最终完全溶解,且高锰酸钾溶液褪色 |
| D、图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.氢气的密度比空气小,利用向上排空气法收集;
B.不能形成闭合回路;
C.浓硫酸与Fe发生钝化,阻止反应的进一步发生;
D.硫酸与碳酸钠反应生成二氧化碳、二氧化碳与硅酸钠反应生成碳酸,均为强酸制取弱酸的反应.
B.不能形成闭合回路;
C.浓硫酸与Fe发生钝化,阻止反应的进一步发生;
D.硫酸与碳酸钠反应生成二氧化碳、二氧化碳与硅酸钠反应生成碳酸,均为强酸制取弱酸的反应.
解答:
解:A.氢气的密度比空气小,利用向上排空气法收集,图中导管短进长出可收集氢气,装置合理,故A正确;
B.不能形成闭合回路,缺少盐桥,则不能验证化学能转化为电能,故B错误;
C.浓硫酸与Fe发生钝化,阻止反应的进一步发生,则不能观察到铁片最终完全溶解,且高锰酸钾溶液褪色,故C错误;
D.硫酸与碳酸钠反应生成二氧化碳、二氧化碳与硅酸钠反应生成碳酸,均为强酸制取弱酸的反应,则酸性为硫酸>碳酸>硅酸,则可比较硫、碳、硅三种元素的非金属性强弱,故D正确;
故选BC.
B.不能形成闭合回路,缺少盐桥,则不能验证化学能转化为电能,故B错误;
C.浓硫酸与Fe发生钝化,阻止反应的进一步发生,则不能观察到铁片最终完全溶解,且高锰酸钾溶液褪色,故C错误;
D.硫酸与碳酸钠反应生成二氧化碳、二氧化碳与硅酸钠反应生成碳酸,均为强酸制取弱酸的反应,则酸性为硫酸>碳酸>硅酸,则可比较硫、碳、硅三种元素的非金属性强弱,故D正确;
故选BC.
点评:本题考查化学实验方案的评价,涉及气体的收集、原电池原理、浓硫酸的性质及非金属性比较、酸性比较等,把握物质性质及反应原理解答的关键,注意方案的合理性、操作性、可行性及评价性分析,选项C为解答的易错点,题目难度中等.

练习册系列答案
相关题目
下列操作错误的是( )(填序号)
| A、用蒸发皿进行加热蒸发实验时,不垫石棉网 |
| B、浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗 |
| C、蒸馏时,将温度计水银球插入液面以下 |
| D、闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中 |
| E、使用分液漏斗和容量瓶时,首先检查是否漏水 |
 在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )
在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )| A、当pH<2.6时,HAc不电离 |
| B、O点时.HAc恰好与NaOH完全反应 |
| C、pH=6.4时溶液中溶质只有NaAc |
| D、50℃,曲线交点O点pH<4.76 |
对实验Ⅰ~Ⅳ的实验现象判断正确的是( )
A、 实验Ⅰ:产生红褐色沉淀 |
B、 实验Ⅱ:试管中溶液变红色 |
C、 实验Ⅲ:试管中溶液变红色 实验Ⅲ:试管中溶液变红色 |
D、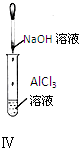 实验Ⅳ:试管中先出现白色沉淀,后溶解 |
关于0.1mol?L-1 NH4Cl溶液,下列说法正确的是( )
| A、c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| B、c(H+)=c(NH3?H2O)+c(OH-) |
| C、加水稀释,溶液中所有离子的浓度均减小 |
| D、向溶液中加入少量CH3COONa固体,NH4+的水解程度增大 |
采用以下措施一定会使一个平衡体系发生移动的是( )
| A、加入一种反应物 |
| B、对平衡体系增加压强 |
| C、改变温度 |
| D、使用催化剂 |

