题目内容
16.下列有关电解质溶液的说法正确的是( )| A. | 向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 向0.1mol•L-1CH3COONa溶液加入少量水,溶液中$\frac{c(CHCO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$>1 | |
| D. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(Cl-)}{c(B{r}^{-})}$减小 |
分析 A.加水促进醋酸的电离;
B.水解常数只受温度影响;
C.根据电荷守恒分析;
D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br-?AgBr(s)+Cl-,该反应的平衡常数K=$\frac{c(Cl-)}{c(B{r}^{-})}$.
解答 解:A.向0.1mol•L-1CH3COOH溶液中加入少量水,加水促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故A错误;
B.向0.1mol•L-1CH3COONa溶液加入少量水,水解常数Kh=$\frac{c(C{H}_{3}COOH)×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$只与温度有关,所以$\frac{c(CHCO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{1}{Kh}$保持不变,故B正确;
C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),显中性,即c(OH-)=c(H+),所以c(Cl-)=c(NH4+),故C错误;
D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br-?AgBr(s)+Cl-,该反应的平衡常数K=$\frac{c(Cl-)}{c(B{r}^{-})}$,向溶液中加入少量AgNO3,K不变,故D错误.
故选B.
点评 本题考查了弱电解质的电离,盐的水解、沉淀溶解平衡等,题目难度中等,注意把握影响平衡常数的因素,侧重于考查学生的分析能力和对基础知识的综合应用能力.

练习册系列答案
相关题目
6.氯原子参与破坏O3的反应
O3+Cl→ClO+O2△H1
ClO+O→Cl+O2△H2
破坏臭氧层的总反应是:O3+O→2O2 △H
该反应的能量变化示意图如图所示: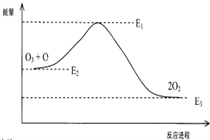
则下列叙述不正确的是( )
O3+Cl→ClO+O2△H1
ClO+O→Cl+O2△H2
破坏臭氧层的总反应是:O3+O→2O2 △H
该反应的能量变化示意图如图所示:

则下列叙述不正确的是( )
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
7. 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | Cu | CuO | Cu(OH)2 |
| ② | CH3CH2OH | CH3CHO | CH2═CH2 |
| ③ | Na2CO3 | NaOH | NaHCO3 |
| ④ | CaCO3 | CaO | Ca(OH)2 |
| A. | ②③ | B. | ③④ | C. | ②④ | D. | ①② |
4.质谱显示,某有机化合物的相对分子质量为46,燃烧实验发现其分子中碳、氢原子数之比为1:3,核磁共振谱显示,该物质中只有一种类型的氢原子.关于该化合物的描述中,正确的是( )
| A. | 该化合物为乙醇 | B. | 该化合物与乙醇互为同分异构体 | ||
| C. | 该化合物为乙醚 | D. | 该化合物与乙醚互为同分异构 |
11.下列晶体中含有非极性共价键的离子晶体是( )
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚.
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚.
| A. | ①②④⑥ | B. | ①③ | C. | ②④⑤⑥ | D. | ③⑤ |
1.已知某有机物9.2g与足量氧气在密闭容器中完全燃烧后,将反应生成的气体依次通过浓硫酸和碱石灰.浓硫酸增重10.8g,碱石灰增重17.6g,该有机物的化学式是( )
| A. | C2H6O | B. | C2H4O | C. | C2H6O2 | D. | CH4O |
8.下列关于常见有机物的说法正确的是( )
| A. | 乙醇、乙酸和乙烯均能使酸性KMnO4溶液褪色 | |
| B. | 乙醇、乙酸和苯均能发生取代反应 | |
| C. | 可用NaCl溶液除去乙酸乙酯中残留的乙酸 | |
| D. | 苯与溴水在催化剂作用下反应可生成溴苯 |
6.下列物质中属于油脂的是( )
| A. | 油酸 | B. | 石油 | C. | 花生油 | D. | 甘油 |