题目内容
18.(1)下列反应用双线桥标出电子转移的方向和数目:2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O(2)氧化剂是KMnO4,氧化产物是Cl2(填化学式).
(3)若生成10mol Cl2消耗的KMnO4是4mol,被氧化的HCl是20 mol.
分析 2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,以此来解答.
解答 解:(1)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,双线桥标出电子的转移方向和数目为 ,
,
故答案为: ;
;
(2)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则氧化产物为Cl2,
故答案为:KMnO4;Cl2;
(3)由反应可知,生成5molCl2消耗的KMnO4是2mol,被氧化的HCl为10mol,则若生成10mol Cl2消耗的KMnO4是4mol,被氧化的HCl是20mol,
故答案为:4;20.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念、氧化还原反应中电子转移等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列气体中能形成酸雨的是( )
| A. | N2 | B. | CO | C. | SO2 | D. | O3 |
13.下列离子方程式正确的是( )
| A. | 铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 硫酸钠溶液和氯化钡溶液反应:Ba2++SO42-=BaSO4↓ |
3.下列说法正确的是( )
| A. | CH3CH2OH、NH4HCO3都属于电解质 | |
| B. | 铝热剂、水玻璃、氨水均为混合物 | |
| C. | 铝、铁对应的氧化物均为碱性氧化物 | |
| D. | 溶液和胶体的本质区别是丁达尔效应 |
10.0.1mol铜与40mL 10mol•L-1 HNO3充分反应后,溶液中含a mol H+,由此可知( )
| A. | 生成的气体在标准状况下的体积为4.48 L | |
| B. | 硝酸只起到强氧化性作用 | |
| C. | 被还原的硝酸的物质的量为(0.2-a) mol | |
| D. | 反应后溶液中所含NO3-的物质的量为0.2 mol |
7.心酮胺是治疗冠心病的药物,它的结构简式如下所示:
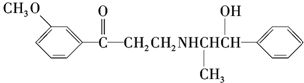
下列关于心酮胺的描述,错误的是( )
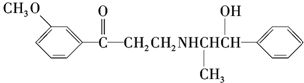
下列关于心酮胺的描述,错误的是( )
| A. | 可以在催化剂作用下和溴发生取代反应 | |
| B. | 可以和银氨溶液发生氧化反应 | |
| C. | 可以和氢溴酸发生取代反应 | |
| D. | 可以和浓硫酸与浓硝酸的混合液发生取代反应 |
8.有关如图所示化合物的说法不正确的是( )


| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1 mol该物质最多可与7 mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
 ;
; .
.