题目内容
有甲、乙、丙三种元素,甲元素的第三电子层的电子数是其第一电子层的电子数的
,乙元素原子核内有8个质子,丙是常见二价金属元素.
(1)写出乙元素的元素符号 ,写出甲元素的离子结构示意图 .
(2)写出甲单质与乙单质在加热条件下的化学方程式 .
(3)已知9.5g丙的氯化物中含有0.2molCl-,则此氯化物的化学式为 .
| 1 |
| 2 |
(1)写出乙元素的元素符号
(2)写出甲单质与乙单质在加热条件下的化学方程式
(3)已知9.5g丙的氯化物中含有0.2molCl-,则此氯化物的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据甲元素M层的电子数是其K层的电子数的
,可知甲为钠;乙元素原子核内有8个质子,可知乙为氧元素;丙是常见二价金属元素可为Mg,据此分析结合题目解答各小题即可.
| 1 |
| 2 |
解答:
解:甲元素M层的电子数是其K层的电子数的
,可知甲为钠,乙元素原子核内有8个质子,可知乙为氧元素,
(1)依据分析可知乙元素为O,元素符号为O,甲元素为Na,钠离子的结构示意图为: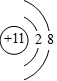 ,故答案为:O;
,故答案为:O;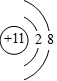 ;
;
(2)钠与氧气加热生成过氧化钠,化学反应方程式为:2Na+O2
Na2O2,故答案为:2Na+O2
Na2O2;
(3)9.5g丙的氯化物中含有0.2molCl-,0.2molCl-的质量为:0.2mol×35.5g/mol=7.1g,故该金属的质量为9.5g-7.1g=2.4g,由于该金属为+2价,故金属的物质的量为0.1mol,故M(金属)=
=24g/mol,故该金属为Mg,故形成的氯化物为MgCl2,故答案为:MgCl2.
| 1 |
| 2 |
(1)依据分析可知乙元素为O,元素符号为O,甲元素为Na,钠离子的结构示意图为:
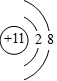 ,故答案为:O;
,故答案为:O;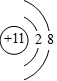 ;
;(2)钠与氧气加热生成过氧化钠,化学反应方程式为:2Na+O2
| ||
| ||
(3)9.5g丙的氯化物中含有0.2molCl-,0.2molCl-的质量为:0.2mol×35.5g/mol=7.1g,故该金属的质量为9.5g-7.1g=2.4g,由于该金属为+2价,故金属的物质的量为0.1mol,故M(金属)=
| 2.4g |
| 0.1mol |
点评:本题主要考查的是元素的推断,抓住甲乙丙三种元素的特点回答是关键.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
已知:①H2O(g)═H2O(l)△H1=-Q1 kJ?mol-1
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
| A、Q1+Q2+Q3 |
| B、0.5Q3-Q2+2Q1 |
| C、0.5Q3+Q2-2Q1 |
| D、0.5(Q1+Q2+Q3) |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A、950mL,11.2g |
| B、500mL,117g |
| C、1000mL,117.0g |
| D、任意规格,111.2g |
下列“化学与生活”的说法不正确的是( )
| A、硫酸钡可用于钡餐透视 |
| B、为防止电池中的重金属离子污染土壤和水源,废电池要集中处理 |
| C、明矾可用于水的消毒、杀菌 |
| D、食醋可用于除去热水瓶中的水垢 |
 (1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为
(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为