题目内容
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物.
回答下列问题:
(1)F的原子的M层电子排布式为
(2)B、C、D的第一电离能由小到大的顺序为
(3)A的简单氢化物分子极易溶于水,其主要原因是
(4)E的最高价氧化物分子的空间构型是
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为
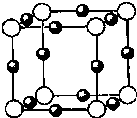
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为
考点:位置结构性质的相互关系应用,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:C元素是地壳中含量最高的金属元素,所以C是Al元素;A原子核外有三个未成对电子,原子序数小于Al,则其电子排布式为1s22s22p3,即A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;化合物B2E的晶体为离子晶体,则B为第三周期第ⅠA族元素,即B为Na元素;由原子序数可知D处于第三周期,D单质的熔点在同周期元素形成的单质中最高,Si的晶体类型为原子晶体,沸点最高,则D为Si元素;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物,则F为Cu,据此解答.
解答:
解:C元素是地壳中含量最高的金属元素,所以C是Al元素;A原子核外有三个未成对电子,原子序数小于Al,则其电子排布式为1s22s22p3,即A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;化合物B2E的晶体为离子晶体,则B为第三周期第ⅠA族元素,即B为Na元素;由原子序数可知D处于第三周期,D单质的熔点在同周期元素形成的单质中最高,Si的晶体类型为原子晶体,沸点最高,则D为Si元素;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物,则F为Cu,
(1)F为Cu,其M层电子排布式为:3s23p63d10,故答案为:3s23p63d10;
(2)同周期随原子序数增大,第一电离能呈增大趋势,故第一电离能Na<Al<Si,故答案为:Na<Al<Si;
(3)由于氨分子与水分子之间存在氢键,故氨气分子极易溶于水,故答案为:氨分子与水分子之间存在氢键;
(4)SO3分子S原子形成3个σ键且不含孤电子对,所以为平面正三角形结构,S原子采取sp2杂化,故答案为:平面正三角形;sp2;
(5)Cu2+与NH3形成[Cu(NH3)4]2+配离子,其配位数为4,故答案为:4;
(6)晶胞中Cu原子数目=12×
=3、N原子数目=8×
=1,故化学式为:Cu3N,晶胞的质量=
g,紧邻的白球与黑球之间的距离为a cm,则晶胞棱长=2a cm,则晶胞体积=(2a cm)3,故晶体的密度=
=
g/cm3,
故答案为:Cu3N;
.
(1)F为Cu,其M层电子排布式为:3s23p63d10,故答案为:3s23p63d10;
(2)同周期随原子序数增大,第一电离能呈增大趋势,故第一电离能Na<Al<Si,故答案为:Na<Al<Si;
(3)由于氨分子与水分子之间存在氢键,故氨气分子极易溶于水,故答案为:氨分子与水分子之间存在氢键;
(4)SO3分子S原子形成3个σ键且不含孤电子对,所以为平面正三角形结构,S原子采取sp2杂化,故答案为:平面正三角形;sp2;
(5)Cu2+与NH3形成[Cu(NH3)4]2+配离子,其配位数为4,故答案为:4;
(6)晶胞中Cu原子数目=12×
| 1 |
| 4 |
| 1 |
| 8 |
| 64×3+14 |
| NA |
| ||
| (2a cm)3 |
| 103 |
| 4NA?a3 |
故答案为:Cu3N;
| 103 |
| 4NA?a3 |
点评:本题考查物质结构与性质,涉及核外电子排布、分子空间构型、原子的杂化、晶胞计算等,注意第ⅡA和第ⅢA族、第ⅤA族和第ⅥA族之间第一电离能异常,注意根据均摊法进行晶胞计算.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列离子方程式正确的是( )
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A、该反应的还原剂是Cl- |
| B、消耗1mol还原剂,转移6mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |
 如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )| A、Cu片上发生氧化反应 |
| B、电子由Cu片经外电路流向Zn片 |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
满足分子式为C4H8ClBr的有机物共有( )
| A、10种 | B、11种 |
| C、12种 | D、13种 |
 如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答: 短周期元素A、B、C、D、F原子序数依次增大.A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,F的负一价离子与C的某种氢化物分子含有相同的电子数.
短周期元素A、B、C、D、F原子序数依次增大.A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,F的负一价离子与C的某种氢化物分子含有相同的电子数.