题目内容
下列水解的离子方程式正确的是( )
| A、S2-+2H2O?H2S+2OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、CO32-+H2O?HCO3-+OH- |
| D、HS-+H2O?H2S↑+OH- |
考点:盐类水解的原理
专题:盐类的水解专题
分析:水解反应为弱酸或弱碱离子结合生成水电离的氢离子或氢氧根离子生成弱电解质的反应,多元弱酸要分步水解,水解方程式要写可逆号,且不能写沉淀和气体符号(双水解除外).
解答:
解:A.硫离子是多元弱酸阴离子分步水解,S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,故A错误;
B.多数弱碱阳离子也是分步水解的,但一般以总反应式表示,所以铁离子的水解方程式为Fe3++3H2O?Fe(OH)3+3H+,故B正确;
C.多元弱酸水解分步进行,所以碳酸根离子水解方程式为CO32-+H2O?HCO3-+OH-,故C正确;
D.硫氢根离子的水解方程式为HS-+H2O?HO-+H2S,水机程度微弱不能生成气体,故D错误.
故选BC.
B.多数弱碱阳离子也是分步水解的,但一般以总反应式表示,所以铁离子的水解方程式为Fe3++3H2O?Fe(OH)3+3H+,故B正确;
C.多元弱酸水解分步进行,所以碳酸根离子水解方程式为CO32-+H2O?HCO3-+OH-,故C正确;
D.硫氢根离子的水解方程式为HS-+H2O?HO-+H2S,水机程度微弱不能生成气体,故D错误.
故选BC.
点评:本题考查了盐类水解离子方程式的书写,明确盐类水解的规律是解题的关键,注意水解不完全用可逆号表示.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
下列化学用语表述正确的是( )
| A、碳酸溶于水的电离方程式:H2CO3?CO32-+2H+ |
| B、标准状况下将112mL Cl2通入10 mL 1 mol?L-1 FeBr2溶液的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C、用单线桥表示浓盐酸和KClO3反应的电子转移的数目与方向: |
D、过氧化钠的电子式为: |
向溶液X中持续通人气体Y,会产生“澄清一浑浊一澄清”现象的是( )
| A、X:漂白粉溶液 Y:二氧化硫 |
| B、X:硝酸钡溶液 Y:二氧化硫 |
| C、X:氯化铝溶液 Y:氨气 |
| D、X:偏铝酸钠溶液 Y:二氧化氮 |
日本大地震、海啸引发多处核险情.下列说法中正确的是( )
| A、核能是一种清洁、环保、安全的新能源 |
| B、核变化属于化学变化 |
| C、氢气的燃烧热最高,且来源丰富、无污染,是一级能源 |
| D、将煤制成气体燃料或液体燃料,可以提高其燃烧效率 |
在等体积的ZnCl2、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
| A、1:2:3 |
| B、2:2:3 |
| C、1:1:1 |
| D、3:3:2 |
下列说法中正确的是( )
| A、已知T1℃时反应C+CO2?2CO;△H>0的速率为v,若升高温度,逆反应速率降低 |
| B、在恒压容器中发生反应N2+O2?2NO,若往容器中充入He,正逆反应的速率均不变 |
| C、对任何一个化学反应,温度发生变化,化学反应速率一定发生变化 |
| D、以上说法均不合理 |
已知NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,则混合物中氧元素的质量分数为( )
| A、16% | B、25% |
| C、50% | D、无法确定 |
下列叙述中正确的是( )
| A、向Ba(NO3)2溶液中通入CO2无沉淀生成,可推知向Ba(NO3)2溶液中通入SO2也无淀生成 |
| B、向FeI2溶液中通入少量Cl2无Fe3+生成,可推知向FeBr2溶液中少量Cl2也无Fe3+生成 |
| C、向品红溶液中加人H2O2溶液时,品红溶液褪色,可推知向品红溶液中通人Cl2时,品红溶液也会褪色 |
| D、向CuSO4溶液中加入铁时会置换出铜,可推知向CuSO4溶液中加人钠时也会置换出铜 |
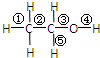 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.