题目内容
Ⅰ、1100℃时,在恒容密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K= .
降低温度,K值减小,则正反应为 (填“吸热”或“放热”)反应.
(2)向该容器中分别加入以下物质,对平衡的影响如何?(填“正向移动”、“逆向移动”或“不发生移动”)
①加入少量Na2SO4,则平衡:
②加入少量灼热的Fe3O4,则平衡:
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则达平衡时该容器内固体的总质量是 g(结果保留3位小数).
(4)若将平衡体系温度降低100℃,下述图象中能正确反映平衡移动过程中容器变化情况的是 .
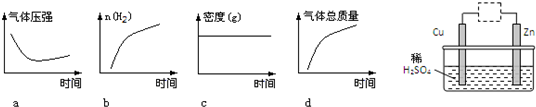
Ⅱ、观察如图装置,下列说法错误的是
A、虚线框中接灵敏电流计,该装置可将化学能转化为电能
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应都相同
C、虚线框中接直流电源,铜电极本身可能发生氧化反应
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到2.24L H2
Ⅲ、已知llg丙烷燃烧生成二氧化碳和水蒸气放热511kJ,1mol液态水变成水蒸气吸热44kJ写出丙烷燃烧热的热化学方程式 .
(1)达到平衡时的平衡常数表达式K=
降低温度,K值减小,则正反应为
(2)向该容器中分别加入以下物质,对平衡的影响如何?(填“正向移动”、“逆向移动”或“不发生移动”)
①加入少量Na2SO4,则平衡:
②加入少量灼热的Fe3O4,则平衡:
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则达平衡时该容器内固体的总质量是
(4)若将平衡体系温度降低100℃,下述图象中能正确反映平衡移动过程中容器变化情况的是

Ⅱ、观察如图装置,下列说法错误的是
A、虚线框中接灵敏电流计,该装置可将化学能转化为电能
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应都相同
C、虚线框中接直流电源,铜电极本身可能发生氧化反应
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到2.24L H2
Ⅲ、已知llg丙烷燃烧生成二氧化碳和水蒸气放热511kJ,1mol液态水变成水蒸气吸热44kJ写出丙烷燃烧热的热化学方程式
考点:化学平衡常数的含义,热化学方程式,原电池和电解池的工作原理,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:Ⅰ、(1)依据化学平衡常数概念书写,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;降低温度,K值减小,说明平衡逆向进行,逆向是放热反应;
(2)①固体不影响化学平衡;
②少量灼热的Fe3O4会和氢气发生反应,平衡逆向进行;
(3)依据化学方程式定量关系计算;
(4)反应是吸热反应,若将平衡体系温度降低100℃,平衡逆向进行;
Ⅱ、A、虚线框中接灵敏电流计,构成原电池反应;
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应是锌和稀硫酸的反应;
C、虚线框中接直流电源,为电解池,铜电极做阳极本身可能发生氧化反应;
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到0.1molH2 ,温度压强不是标准状况,气体体积不一定是2,24L;
Ⅲ、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,定量计算1mol丙烷燃烧生成二氧化碳和水蒸气放出的热量,标注物质聚集状态和对应反应焓变书写热化学方程式,依据盖斯定律计算得到所需丙烷的燃烧热化学方程式.
(2)①固体不影响化学平衡;
②少量灼热的Fe3O4会和氢气发生反应,平衡逆向进行;
(3)依据化学方程式定量关系计算;
(4)反应是吸热反应,若将平衡体系温度降低100℃,平衡逆向进行;
Ⅱ、A、虚线框中接灵敏电流计,构成原电池反应;
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应是锌和稀硫酸的反应;
C、虚线框中接直流电源,为电解池,铜电极做阳极本身可能发生氧化反应;
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到0.1molH2 ,温度压强不是标准状况,气体体积不一定是2,24L;
Ⅲ、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,定量计算1mol丙烷燃烧生成二氧化碳和水蒸气放出的热量,标注物质聚集状态和对应反应焓变书写热化学方程式,依据盖斯定律计算得到所需丙烷的燃烧热化学方程式.
解答:
解:Ⅰ、(1)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),固体不写在平衡常数表达式中,平衡常数K=
,降低温度,K值减小,说明平衡逆向进行,逆反应方向是放热反应,正反应方向为吸热反应,
故答案为:
;吸热;
(2)①加入少量Na2SO4,硫酸钠是固体不允许化学平衡和反应速率,则平衡不发生移动,故答案为:不发生移动;
②加入少量灼热的Fe3O4,氢气和四氧化三铁反应生成铁和水,则平衡Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),向逆向进行,故答案为:逆向移动;
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,依据化学方程式Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),反应前后固体质量减少计算,Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△m减小
142g 64g
2.84g×45% m
m=0.576g
固体质量剩余2.84g-0.576g=2.264g;
则达平衡时该容器内固体的总质量是2.264g;
故答案为:2.264;
(4)反应是吸热反应,若将平衡体系温度降低100℃,平衡逆向进行;
a、平衡逆向进行气体压强减小,故a不符合;
b、平衡逆向进行,氢气物质的量增大,故b符合;
c、反应前后气体质量发生变化,密度随反应进行发生变化,故c不符合;
d、逆向进行气体质量减小,故d不符合;
故答案为:b;
Ⅱ、A、虚线框中接灵敏电流计,构成原电池反应,锌做负极,发生氧化还原反应,化学能转化为电能,故A正确;
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应是锌和稀硫酸的反应,与电流计无关,故B正确;
C、虚线框中接直流电源,为电解池,若铜电极做阳极,本身可能发生氧化反应,故C正确;
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到0.1molH2 ,温度压强不是标准状况,气体体积不一定是2,24L,故D错误;
故答案为:D;
Ⅲ、已知llg丙烷燃烧生成二氧化碳和水蒸气放热511kJ,44g丙烷燃烧生成二氧化碳和水蒸气放热为2044KJ,热化学方程式为:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044KJ/mol;1mol液态水变成水蒸气吸热44kJ,②H2O(l)=H2O(g)△H=+44KJ/mol;依据盖斯定律计算丙烷燃烧热,①-②×4得到丙烷燃烧热的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220KJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220KJ/mol.
| c4(H2O) |
| c4(H2) |
故答案为:
| c4(H2O) |
| c4(H2) |
(2)①加入少量Na2SO4,硫酸钠是固体不允许化学平衡和反应速率,则平衡不发生移动,故答案为:不发生移动;
②加入少量灼热的Fe3O4,氢气和四氧化三铁反应生成铁和水,则平衡Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),向逆向进行,故答案为:逆向移动;
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,依据化学方程式Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),反应前后固体质量减少计算,Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△m减小
142g 64g
2.84g×45% m
m=0.576g
固体质量剩余2.84g-0.576g=2.264g;
则达平衡时该容器内固体的总质量是2.264g;
故答案为:2.264;
(4)反应是吸热反应,若将平衡体系温度降低100℃,平衡逆向进行;
a、平衡逆向进行气体压强减小,故a不符合;
b、平衡逆向进行,氢气物质的量增大,故b符合;
c、反应前后气体质量发生变化,密度随反应进行发生变化,故c不符合;
d、逆向进行气体质量减小,故d不符合;
故答案为:b;
Ⅱ、A、虚线框中接灵敏电流计,构成原电池反应,锌做负极,发生氧化还原反应,化学能转化为电能,故A正确;
B、虚线框中无论是否接灵敏电流计,装置中所涉及的化学反应是锌和稀硫酸的反应,与电流计无关,故B正确;
C、虚线框中接直流电源,为电解池,若铜电极做阳极,本身可能发生氧化反应,故C正确;
D、虚线框中接灵敏电流计或接直流电源,当转移0.2mol电子时,都能得到0.1molH2 ,温度压强不是标准状况,气体体积不一定是2,24L,故D错误;
故答案为:D;
Ⅲ、已知llg丙烷燃烧生成二氧化碳和水蒸气放热511kJ,44g丙烷燃烧生成二氧化碳和水蒸气放热为2044KJ,热化学方程式为:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044KJ/mol;1mol液态水变成水蒸气吸热44kJ,②H2O(l)=H2O(g)△H=+44KJ/mol;依据盖斯定律计算丙烷燃烧热,①-②×4得到丙烷燃烧热的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220KJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220KJ/mol.
点评:本题考查了化学反应速率、化学平衡常数、化学平衡影响因素分析判断,热化学方程式书写,原电池和电解池的原理分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
钢是用量最大、用途最广的合金,其主要成分为铁.铁的核素
Fe中的质子数为( )
56 26 |
| A、26 | B、30 | C、56 | D、82 |
X、Y、Z、W、U是分别位于短周期的元素,原子序数依次递增.X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.Y元素的单质在X的某种氧化物中可燃.下列说法正确的是( )
| A、W的最高价氧化物能与水反应生成相应的酸 |
| B、M原子核内比X多一个质子,M的气态氢化物的水溶液能溶解Z的氧化物 |
| C、U单质可以溶解于X和U形成的化合物中 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
 (1)甲醇是一种优质燃料,可制作燃料电池.
(1)甲醇是一种优质燃料,可制作燃料电池.