题目内容
将含有C、H、O的有机物3.0g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8g,B管质量增加了4.4g,已知该有机物的相对分子质量为60.
(1)燃烧此有机物3.0g需消耗O2(标准状况) L;
(2)求此有机物的分子式 .
(1)燃烧此有机物3.0g需消耗O2(标准状况)
(2)求此有机物的分子式
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)根据质量守恒计算消耗氧气的质量,进而计算消耗氧气的体积;
(2)A管质量增加1.8g为生成水的质量,B管质量增加4.4g为生成二氧化碳的质量,根据n=
计算有机物、水、二氧化碳的物质的量,根据原子守恒计算有机物分子中N(C)、N(H),再根据有机物的相对分子质量计算分子中N(O),确定有机物分子式.
(2)A管质量增加1.8g为生成水的质量,B管质量增加4.4g为生成二氧化碳的质量,根据n=
| m |
| M |
解答:
解:(1)化学反应遵循质量守恒定律,则消耗O2的质量为:1.8g+4.4g-3g=3.2g,其物质的量=
=0.1mol,故氧气体积=0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(2)CaCl2中吸水质量增加1.8g,水的物质的量=
=0.1mol,n(H)=0.2mol,
碱石灰吸CO2增加4.4g,二氧化碳物质的量=
=0.1mol,n(C)=0.1mol
该有机物物质的量为
=0.05mol,
所以有机物分子中N(C)=
=2,N(H)=
=4,N(O)=
=2,
所以有机物的分子式为:C2H4O2,
故答案为:C2H4O2.
| 3.2g |
| 32g/mol |
故答案为:2.24;
(2)CaCl2中吸水质量增加1.8g,水的物质的量=
| 1.8g |
| 18g/mol |
碱石灰吸CO2增加4.4g,二氧化碳物质的量=
| 4.4g |
| 44g/mol |
该有机物物质的量为
| 3g |
| 60g/mol |
所以有机物分子中N(C)=
| 0.1mol |
| 0.05mol |
| 0.2mol |
| 0.05mol |
| 60-12×2-4 |
| 16 |
所以有机物的分子式为:C2H4O2,
故答案为:C2H4O2.
点评:本题考查有机物分子式的确定,题目难度中等,掌握燃烧法利用守恒确定有机物的分子式,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组顺序的排列不正确的是( )
| A、非金属性:Si>C>P>Cl>F |
| B、热稳定性;HCl>H2S>PH3>AsH3 |
| C、酸性强弱:H3AlO3<H2SiO4<H2CO3<H3PO4 |
| D、离子半径;F->Na+>Mg2+>Al3+ |

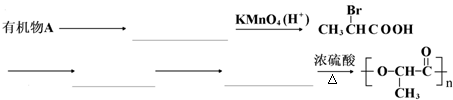
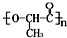 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)