题目内容
写出下列物质在水溶液中的电离方程式
氯化铜
硫酸铁
碳酸氢钠
硫酸氢钠 .
氯化铜
硫酸铁
碳酸氢钠
硫酸氢钠
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
解答:
解:氯化铜是强电解质,电离时电离出自由移动的铜离子和氯离子,CuCl2=Cu2++2Cl-,
硫酸铁强电解质,电离时电离出自由移动的铁离子和硫酸根离子,Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
硫酸铁强电解质,电离时电离出自由移动的铁离子和硫酸根离子,Fe2(SO4)3=2Fe3++3SO42-,
碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;NaHCO3═Na++HCO3;NaHSO4═Na++H++SO42-.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,碳酸氢钠电离为该题易错点,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、0.1 mol?L-1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
| B、常温下,在由水电离出的c(OH-)=1×10-12mol?L-1的溶液中,Al3+可能大量存在 |
| C、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D、常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
下列反应中,属于氧化还原反应的是( )
| A、SO2+H2O═H2SO3 |
| B、2Fe(OH)3═Fe2O3+3H2O |
| C、2Na+2H2O═2NaOH+H2↑ |
| D、Cu(OH)2+2HCl═CuCl2+2H2O |
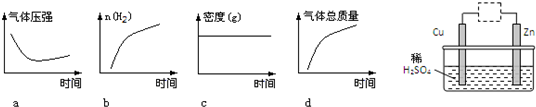
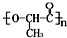 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)
是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的大部分塑料袋.请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)