题目内容
Cl2是一种十分活泼的非金属单质,除了具有极强的氧化性外,还可以在一定条件下与NaOH等碱溶液反应,如3Cl2+6NaOH(浓)
5NaCl+NaClO3+3H2O.在该反应中,氯元素发生的变化是( )
| ||
| A、只是被氧化 |
| B、只是被还原 |
| C、有的被氧化,有的被还原 |
| D、既未被氧化,也未被还原 |
考点:氧化还原反应,氯气的化学性质
专题:氧化还原反应专题
分析:3Cl2+6NaOH(浓)
5NaCl+NaClO3+3H2O,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
| ||
解答:
解:3Cl2+6NaOH(浓)
5NaCl+NaClO3+3H2O,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,
所以氯元素在该反应中既失去电子又得到电子,
即Cl元素有的被氧化,有的被还原,
故选:C.
| ||
所以氯元素在该反应中既失去电子又得到电子,
即Cl元素有的被氧化,有的被还原,
故选:C.
点评:本题考查氧化还原反应,侧重氧化还原反应中基本概念的考查,明确反应中元素的化合价变化为解答的关键,题目较简单.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、水的摩尔质量是18g |
| B、HCl的摩尔质量等于NA个HCl分子的质量 |
| C、摩尔是七个基本物理量之一 |
| D、1mol CO2的质量以克为单位时,在数值上等于CO2的相对分子质量 |
对于可逆反应:C(s)+CO2(g)?2CO(g),在一定温度下其平衡常数为K.下列条件的变化中,能使K值发生变化的是( )
| A、将C(s)的表面积增大 |
| B、增大体系的压强 |
| C、升高体系的温度 |
| D、使用合适的催化剂 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、使甲基橙呈红色的溶液:NH4+、Na+、Al02-、HC03- | ||
| B、c(NH3?H2O)=1.Omol?L-1的溶液:K+、Al3+、S042-、Cl- | ||
| C、由水电离的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
D、在
|
下列各种说法中正确的是( )
| A、极性键只能形成极性分子 |
| B、CO2中碳原子是sp2杂化 |
| C、形成配位键的条件是一方有空轨道,另一方有孤对电子 |
| D、共价键形成的条件是成键原子必须有未成对电子 |
 新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )| A、MFe2O4在与H2的反应中表现了氧化性 |
| B、MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C、MFe2Ox与SO2反应中MFe2Ox被还原 |
| D、若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
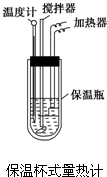 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.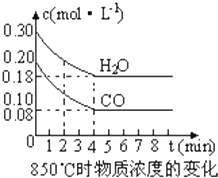 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示