题目内容
在某温度时,测得纯水中的c(H+)=2.0×10-7 mol·L-1,则c(OH-)为
| A.2.0×10-7 mol·L-1 |
| B.0.1×10-7 mol·L-1 |
| C.1.0×10-14/2.0×10-7 mol·L-1 |
| D.无法确定 |
A
解析

 阅读快车系列答案
阅读快车系列答案下列有关用途的说法中,错误的是
| A.液态钠可用作核反应堆的传热介质 | B.在过渡元素中寻找半导体材料 |
| C.考古时利用l4C测定一些文物的年代 | D.235U是一种重要核燃料 |
在相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.电离度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
| A.10mL | B.40mL | C.大于40mL | D.小于40ml |
(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL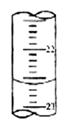
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验 编号 | NaOH溶液的浓度 (mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 25.80 | 20.00 |
| 3 | 0.10 | 22.62 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
下列物质中,其产量可以用来衡量一个国家石油化工发展水平的是
| A.甲烷 | B.乙烯 | C.汽油 | D.乙醇 |
下列仪器中不能用于加热的是
| A.试管 | B.烧杯 | C.容量瓶 | D.坩埚 |
 2NH3 (g) 达到平衡状态标志的是
2NH3 (g) 达到平衡状态标志的是