题目内容
8.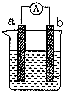 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:2Al+6H+=2Al3++3H2↑.
正极的电极反应式为:2H++2e-=H2↑.
当a极溶解的质量为5.4g时,有0.6mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置能(填“能”或“不能”)形成原电池,若不能,请说明理由Al为负极,且与NaOH溶液发生氧化还原反应(若能该空不作答),若能,该原电池的正极为Mg;该原电池总的化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 (1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子;
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,以此来解答.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子,则电池反应的离子反应为2Al+6H+=2Al3++3H2↑,正极反应为2H++2e-=H2↑,a溶解的n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,通过的电子为0.2mol×(3-0)=0.6mol,
故答案为:2Al+6H+=2Al3++3H2↑;2H++2e-=H2↑;0.6;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:能;Al为负极,且与NaOH溶液发生氧化还原反应;Mg;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查原电池原理,为高频考点,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电极、电极反应、转移电子的考查,注意(2)中不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
16.一定条件下:甲分子和乙反应应生成丙分子和丁分子,下列不正确的是( )


| A. | 该反应类型是置换反应 | B. | 甲的空间构型是平面正六边形 | ||
| C. | 丙不属于烃类物质 | D. | 分离甲和丙可以采用蒸馏法 |
3.SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O═SO42-+2Fe2++4H+②Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
下列有关说法不正确的是( )
下列有关说法不正确的是( )
| A. | SO2发生氧化反应 | |
| B. | 氧化性:Cr2O72->Fe3+>SO42- | |
| C. | 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA | |
| D. | 若6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
13.如图选用的相关仪器(固定装置略去)符合实验要求的是( )
| A. |  存放浓硝酸 | B. |  可用于制备氨气 | ||
| C. |  蒸干氯化铝溶液AlCl3•6H2O晶体 | D. |  实验室抽取乙烯 |
20.两种金属的混合物3g投入水中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
18.下列化学药品中属有毒且易燃料是( )
| A. | 乙酸 | B. | 氰化钾 | C. | 甲醇 | D. | 氢气 |
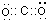 ;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N.
;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N. ,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.