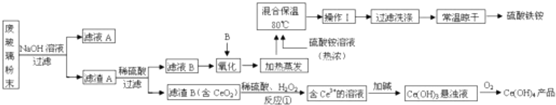
题目内容
莫尔法是实验室和工业生产中常用的一种测定氯离子含量的滴定分析手段,以AgNO3标准溶液为滴定剂、K2CrO4为指示剂,于中性或弱碱性溶液中测定Cl-的分析方法.它是利用加入的银离子能与氯离子反应产生沉淀,当氯离子完全反应时(化学上一般认为离子浓度小于10-5mol/L时,沉淀就达完全),会与指示剂反应,产生有色沉淀,表明达到滴定终点.某化学兴趣组同学用该法测定工业盐中NaCl的含量.(已知工业盐中含有超标NaNO2等杂质).
通过查阅资料,同学们知道了3种物质的溶度积:AgNO2(淡黄色)Ksp=6.0×10-4;AgCl(白色)Ksp=2.0×10-10;Ag2CrO4(砖红色) Ksp=2.0×10-12.实验步骤如下:
①取m g样品溶于约50mL蒸馏水,定容至250mL
②准确移取25.00mL溶液于锥形瓶中,加入适量稀硝酸酸化
③选用合适氧化剂做适当处理
④除去过量的氧化剂
⑤
⑥用浓度为c mol/L的标准AgNO3滴定,记下消耗的AgNO3体积
⑦平行测定3次,平均消耗AgNO3 V mL
请根据以上描述,回答下列问题:
(1)依次写出滴定过程中发生反应的离子方程式: .
(2)滴定前为什么要用氧化剂做预处理? .
(3)用氧化剂处理时,可以选用的氧化剂有 .
A、KMnO4 B、K2Cr2O7 C、H2O2 D、KClO3
(4)写出实验步骤⑤ .
(5)滴定时指示剂的浓度将会影响测定结果,试利用所学知识,计算锥形瓶中K2CrO4的浓度应该控制在 mol/L为宜.
(6)写出样品中NaCl含量的计算式 .
通过查阅资料,同学们知道了3种物质的溶度积:AgNO2(淡黄色)Ksp=6.0×10-4;AgCl(白色)Ksp=2.0×10-10;Ag2CrO4(砖红色) Ksp=2.0×10-12.实验步骤如下:
①取m g样品溶于约50mL蒸馏水,定容至250mL
②准确移取25.00mL溶液于锥形瓶中,加入适量稀硝酸酸化
③选用合适氧化剂做适当处理
④除去过量的氧化剂
⑤
⑥用浓度为c mol/L的标准AgNO3滴定,记下消耗的AgNO3体积
⑦平行测定3次,平均消耗AgNO3 V mL
请根据以上描述,回答下列问题:
(1)依次写出滴定过程中发生反应的离子方程式:
(2)滴定前为什么要用氧化剂做预处理?
(3)用氧化剂处理时,可以选用的氧化剂有
A、KMnO4 B、K2Cr2O7 C、H2O2 D、KClO3
(4)写出实验步骤⑤
(5)滴定时指示剂的浓度将会影响测定结果,试利用所学知识,计算锥形瓶中K2CrO4的浓度应该控制在
(6)写出样品中NaCl含量的计算式
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验题
分析:(1)根据滴定过程涉及反应写离子方程式;
(2)根据题给信息AgNO2也是沉淀(淡黄色)会干扰滴定终点观察,故需加氧化剂除去亚硝酸根离子;
(3)根据除杂原则和是否会干扰试验选择氧化剂;
(4)根据题给信息需调节溶液PH,加入指示剂;
(5)根据氯化银溶度积计算氯离子沉淀完全时银离子浓度,根据铬酸银溶度积计算铬酸根离子浓度;
(6)根据方程式计算氯化钠的质量进而计算质量分数.
(2)根据题给信息AgNO2也是沉淀(淡黄色)会干扰滴定终点观察,故需加氧化剂除去亚硝酸根离子;
(3)根据除杂原则和是否会干扰试验选择氧化剂;
(4)根据题给信息需调节溶液PH,加入指示剂;
(5)根据氯化银溶度积计算氯离子沉淀完全时银离子浓度,根据铬酸银溶度积计算铬酸根离子浓度;
(6)根据方程式计算氯化钠的质量进而计算质量分数.
解答:
解:(1)根据题给信息:它是利用加入的银离子能与氯离子反应产生沉淀,当氯离子完全反应时(化学上一般认为离子浓度小于10-5mol/L时,沉淀就达完全),会与指示剂反应,产生有色沉淀,表明达到滴定终点,题中指示剂为K2CrO4,故涉及反应离子方程式为:Ag++Cl-=AgCl↓ 2Ag++CrO42-=Ag2CrO4↓;
故答案为:Ag++Cl-=AgCl↓、2Ag++CrO42-=Ag2CrO4↓;
(2)已知工业盐中含有超标NaNO2等杂质,根据题给信息AgNO2也是沉淀(淡黄色)会干扰滴定终点观察,故需加氧化剂除去亚硝酸根离子;
故答案为:工业盐中含有NaNO2 也可以和Ag+产生沉淀,会影响实验结果,用氧化剂可以将其氧化为硝酸盐,从而消除对实验的影响;
(3)除杂的原则之一是不引入新的杂质且不影响试验,只有C还原产物为水,不引入新的杂质也和硝酸银不反应,高锰酸钾有颜色干扰试验,K2Cr2O7会和银离子沉淀,氯酸钾也和银离子沉淀,故选C;
故答案为:C;
(4)根据题给信息:K2CrO4为指示剂,于中性或弱碱性溶液中测定Cl-的分析方法,故滴定前需调节PH和加入指示剂;
故答案为:用适量的碱将溶液调成中性或弱碱性,滴入适量的K2CrO4作指示剂;
(5)化学上一般认为离子浓度小于10-5mol/L时,沉淀就达完全,c(Cl-)=1×10-5,根据AgCl(白色)Ksp=2.0×10-10,
则c(Ag+)=
=2×10-5,
因Ag2CrO4(砖红色) Ksp=2.0×10-12,则c(CrO42-)=
=5×10-3
故答案为:5×10-3;
(6)AgNO3 +NaCl=AgCl↓+NaNO3
1mol 58.5g
cmol/L×VmL×10-3L/mL m
m=
=5.85cV×10-3g,
样品中NaCl含量的计算式为:
×100%;
故答案为:
×100%.
故答案为:Ag++Cl-=AgCl↓、2Ag++CrO42-=Ag2CrO4↓;
(2)已知工业盐中含有超标NaNO2等杂质,根据题给信息AgNO2也是沉淀(淡黄色)会干扰滴定终点观察,故需加氧化剂除去亚硝酸根离子;
故答案为:工业盐中含有NaNO2 也可以和Ag+产生沉淀,会影响实验结果,用氧化剂可以将其氧化为硝酸盐,从而消除对实验的影响;
(3)除杂的原则之一是不引入新的杂质且不影响试验,只有C还原产物为水,不引入新的杂质也和硝酸银不反应,高锰酸钾有颜色干扰试验,K2Cr2O7会和银离子沉淀,氯酸钾也和银离子沉淀,故选C;
故答案为:C;
(4)根据题给信息:K2CrO4为指示剂,于中性或弱碱性溶液中测定Cl-的分析方法,故滴定前需调节PH和加入指示剂;
故答案为:用适量的碱将溶液调成中性或弱碱性,滴入适量的K2CrO4作指示剂;
(5)化学上一般认为离子浓度小于10-5mol/L时,沉淀就达完全,c(Cl-)=1×10-5,根据AgCl(白色)Ksp=2.0×10-10,
则c(Ag+)=
| 2.0×10-10 |
| 1×10-5 |
因Ag2CrO4(砖红色) Ksp=2.0×10-12,则c(CrO42-)=
| 2.0×10-12 |
| (2×10-5)2 |
故答案为:5×10-3;
(6)AgNO3 +NaCl=AgCl↓+NaNO3
1mol 58.5g
cmol/L×VmL×10-3L/mL m
m=
| 58.5g×cV×10-3mol |
| 1mol |
样品中NaCl含量的计算式为:
| 5.85cV×10-3×10 |
| m |
故答案为:
| 5.85cV×10-3×10 |
| m |
点评:本题考查了滴定操作的原理及沉淀溶解平衡的计算,中等难度,注意从题给信息获得解题突破口.

练习册系列答案
相关题目
维生素C可用于预防治疗坏血病,其结构如图所示.下列关于维生素C的叙述错误的是( )

| A、维生素C难溶于水 |
| B、维生素C可作食品添加剂 |
| C、维生素C不可能发生水解反应 |
| D、维生素C能发生氧化反应 |
将一小块钠投入下列溶液中,既能产生气体又会出现红褐色沉淀的是( )
| A、稀H2SO4 |
| B、氢氧化钠溶液 |
| C、硫酸铜溶液 |
| D、氯化铁溶液 |
下列各组液体混合物,能用分液漏斗分离的是( )
| A、醋酸和水 | B、四氯化碳和水 |
| C、汽油和苯 | D、酒精和水 |

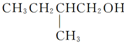 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式: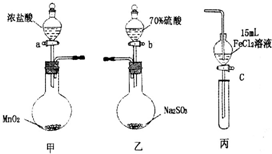 为验证氧化性
为验证氧化性