题目内容
13.今年是居里夫人因发现镭元素l05周年.已知镭原子的核内质子数为88.常温下,镭是一种银白色同体.质软,密度为6.0g/cm3,熔点为700℃,易与水反应生成氢氧化镭(镭显+2价)和氢气.回答下列问题:(1)镭原子的核外电子数为88.
(2)写出镭(Rn)与水反应的化学方程式:Ra+2H20═Ra(OH)2+H2 ↑.
分析 (1)在原子中,核内质子数等于核外电子数;
(2)镭与水反应生成氢氧化镭和氢气.
解答 解:(1)镭原子的核内质子数为88,则镭原子的核外电子数为88,
故答案为:88.
(2)镭与水反应生成氢氧化镭和氢气,镭与水反应的化学方程式:Ra+2H20═Ra(OH)2+H2 ↑,
故答案为:Ra+2H20═Ra(OH)2+H2 ↑.
点评 本题主要考查物质的性质和化学方程式的书写等方面的知识,根据题干信息以及书写化学方程式时要注意遵循质量守恒定律是解答关键,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
3.下列说法错误的是( )
| A. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
1.化学中有许多物质之间的反应符合如图转化.图中其他产物及反应所需条件均已略去.下列说法不正确的是( )
A$\stackrel{X}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{O_{2}}{→}$D.
A$\stackrel{X}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{O_{2}}{→}$D.
| A. | 当A是正盐,X是强酸时,D是酸性氧化物 | |
| B. | 当X时强碱溶液时,B一定时NH3 | |
| C. | B可能是单质 | |
| D. | D可能是一种酸 |
8.下列反应的可能为4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O的是( )
| A. | 在氯化铝溶液中滴加氨水 | B. | 在偏铝酸钠溶液中通入CO2 | ||
| C. | 在氯化铝溶液中滴加氢氧化钠溶液 | D. | 在硫酸铝溶液中滴加偏铝酸钠溶液 |
18.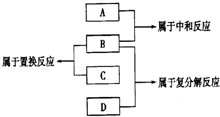 现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
 现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )| A. | A铁 | B. | B盐酸 | C. | C氢氧化钠溶液 | D. | D硝酸银溶液 |