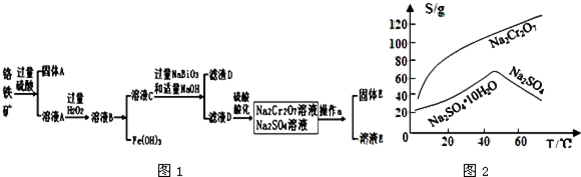
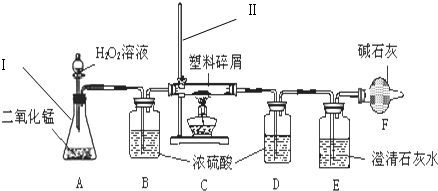
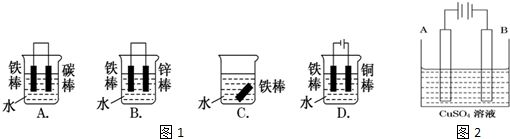
题目内容
4.常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/L CH3COOH溶液,得到2条滴定曲线,如图所示.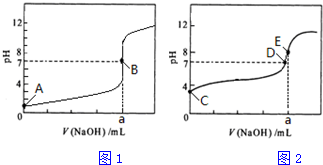
(1)CH3COOH的电离方程式是CH3COOH?CH3COO-+H+;
(2)由A、C点判断,滴定HCl溶液的曲线是图1(填“图1”或“图2”),图象中a=20.00mL;
(3)用NaOH溶液滴定CH3COOH时选用酚酞做指示剂,当V(NaOH)=10.00mL时,滴定CH3COOH所得溶液中的物料守恒式是c(CH3COOH)+c(CH3COO-)=2c(Na+);
(4)D点所示溶液中c(Na+)﹦c(CH3COO-)(填“>”、“<”、“﹦”);
(5)E点对应的溶液pH>7,原因是CH3COO-+H2O?CH3COOH+OH-(用离子方程式表示),溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
分析 (1)醋酸是弱酸存在电离平衡;
(2)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
(3)用NaOH溶液滴定CH3COOH时恰好反应生成的醋酸钠溶液显碱性,指示终点的指示剂变色范围应在碱性中,酚酞变色范围8-10;常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液,当V(NaOH)=10.00mL时,得到等浓度的醋酸钠和醋酸混合溶液,据此书写溶液中物料守恒;
(4)D点处溶液PH=7,结合溶液中电荷守恒;
(5)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液,图1可知B点对应的溶液pH=7,a为20.00mL,E点是常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液,用去氢氧化钠溶液体积20.00ml,恰好反应生成醋酸钠,溶液中醋酸根离子水解溶液显碱性.
解答 解:(1)CH3COOH的电离方程式是:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(2)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,滴定20.00mL 0.1000mol/L HCl溶液,NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HCl)=n(NaOH),则a=20.00mL,
故答案为:图1;20.00;
(3)用NaOH溶液滴定CH3COOH时恰好反应生成的醋酸钠溶液显碱性,指示终点的指示剂变色范围应在碱性中,酚酞变色范围8-10,用NaOH溶液滴定CH3COOH时选用 酚酞做指示剂,常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液,当V(NaOH)=10.00mL时,得到等浓度的醋酸钠和醋酸混合溶液,溶液中存在物料守恒为:c(CH3COOH)+c(CH3COO-)=2 c(Na+),
故答案为:酚酞,c(CH3COOH)+c(CH3COO-)=2 c(Na+);
(4)图象分析可知D点所示溶液在常温下PH=7,溶液呈中性,c(H+)=c(OH-),存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得到c(Na+)=c(CH3COO-),故答案为:﹦;
(5)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液,图1可知B点对应的溶液pH=7,a为20.00mL,E点是常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液,用去氢氧化钠溶液体积20.00ml,恰好反应生成醋酸钠,溶液中醋酸根离子水解溶液显碱性,E点对应的溶液pH>7,原因是:CH3COO-+H2O?CH3COOH+OH-,溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:CH3COO-+H2O?CH3COOH+OH-,c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评 本题考查了酸碱混合时溶液定性判断及有关pH的简单计算,题目难度中等,注意掌握根据电荷守恒、物料守恒比较溶液中离子浓度定性关系的方法.注意过程的分析.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 工业上合成氨采用铁触媒作催化剂加快反应速率 | |
| B. | 啤酒瓶打开瓶盖产生大量气泡 | |
| C. | 加热蒸发MgCl2溶液得到Mg(OH)2 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
| A. | 中性溶液中pD=8-lg4 | |
| B. | 含有0.01 mol NaOD的D2O溶液1 L,pD=12.0 | |
| C. | 溶解0.01 mol DCl的D2O溶液1 L,pD=12.0 | |
| D. | 在100 mL 0.25 mol/L的DCl重水溶液中,加入50 mL 0.20 mol/L NaOD重水溶液,pD=1.0 |
| A. | 水制冰块 | B. | 菠萝榨汁 | C. | 食物腐烂 | D. | 蔗糖溶解 |