题目内容
9.下列离子方程式的书写正确的是( )| A. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO3- | |
| B. | Na202加入H2180中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 |
分析 A.二氧化碳过量,反应生成碳酸氢钙;
B.过氧化钠与水的反应中,氧气中氧元素完全来自过氧化钠;
C.氢氟酸为弱酸,离子方程式中不能拆开,且该反应无法书写离子方程式;
D.二氧化碳过量,反应生成碳酸氢根离子,且硅酸钠应该拆开.
解答 解:A.过量C02通入氢氧化钙溶液中,反应生成碳酸氢钙,反应的离子方程式为:CO2+OH-═HCO3-,故A正确;
B.Na202加入H2180中,水中氧元素完全转化成氢氧根离子,正确的离子方程式为:2Na2O2+2H218O═4Na++2OH-+218OH-+O2↑,故B错误;
C.硅与氢氟酸的反应为:Si+4HF═SiF4↑+2H2↑,该反应无法书写离子方程式,故C错误;
D.水玻璃中通人过量二氧化碳,反应生成硅酸沉淀和碳酸氢钠,正确的离子方程式为:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
20.将 4mol A气体和 2mol B气体在 2L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得C的浓度为 0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质A表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为 0.7 mol•L-1 |
17.合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.
(1)已知:①N2(g)+O2(g)═2NO(g)△H1
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用△H1、△H2、△H3表达)
(2)图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
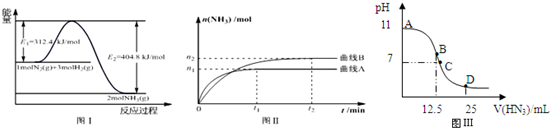
①下列说法正确的是AE.
A.△H=-92.4kJ•mol-1
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.该反应的平衡常数KA<KB
F.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/4t1mol•L-1•min-1
②下列能说明该反应达到平衡状态的是C
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如表:
①理论上,为了增大平衡时H2的转化率,可采取的措施是增大压强、适当增大氮氢比、及时分离出产物中的NH3(要求答出两点).
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入0.2mol/L的HN3溶液,溶液的pH变化曲线如图Ⅲ所示.A、B、C、D 四个点中,水的电离程度最大的是B;D点时溶液中各离子浓度大小顺序为c(N3-)>c(NH4+)>c(H+)>c(OH-).
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
(1)已知:①N2(g)+O2(g)═2NO(g)△H1
②N2(g)+3H2(g)?2NH3(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3-2△H1-2△H2(用△H1、△H2、△H3表达)
(2)图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.

①下列说法正确的是AE.
A.△H=-92.4kJ•mol-1
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.该反应的平衡常数KA<KB
F.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/4t1mol•L-1•min-1
②下列能说明该反应达到平衡状态的是C
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入0.2mol/L的HN3溶液,溶液的pH变化曲线如图Ⅲ所示.A、B、C、D 四个点中,水的电离程度最大的是B;D点时溶液中各离子浓度大小顺序为c(N3-)>c(NH4+)>c(H+)>c(OH-).
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
4.下列关于胶体的说法正确的是( )
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |
1.常温下,下列溶液中粒子浓度关系正确的是( )
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
18.下列物质的包装箱应贴上右图标志的是( )


| A. | 硫酸钠 | B. | 酒精 | C. | 浓硫酸 | D. | 氢氧化钠 |
19.下列有关物质用途的描述不符合事实的是( )
| A. | 碳酸氢钠可用作食品添加剂 | B. | 过氧化钠可用作潜水艇供氧剂 | ||
| C. | 铝制容器可以贮运稀硝酸 | D. | 氧化铁可用作外墙涂料 |