题目内容
实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气.求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为多少?参加反应的HCl物质的量有多少?
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质量浓度.(已知溶液中生成沉淀的反应可以简写成Ag++Cl-=Ag Cl↓,要求写出规范的解题过程)
| ||
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为多少?参加反应的HCl物质的量有多少?
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质量浓度.(已知溶液中生成沉淀的反应可以简写成Ag++Cl-=Ag Cl↓,要求写出规范的解题过程)
考点:化学方程式的有关计算,氯气的实验室制法
专题:计算题
分析:①8.7g的MnO2,n(MnO2)=
=0.1mol,将其物质的量代入方程式计算氯气及参加反应的HCl;
②加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),以此计算.
| 8.7g |
| 87g/mol |
②加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),以此计算.
解答:
解:①8.7g的MnO2,n(MnO2)=
=0.1mol,设生成氯气为xL,参加反应的HCl为ymol,则
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1 4 22.4L
0.1mol y x
=
,
=
,
解得x=2.24L,y=0.4mol,
答:产生的氯气在标准状况下的体积为2.24L,参加反应的HCl物质的量有0.4mol;
②加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),
n(AgCl)=
=0.4mol,n(Cl2)=0.1mol,
n(HCl)总=0.4mol+0.1mol×2=0.6mol,则c(HCl)=
=12mol/L,
答:原浓盐酸的物质量浓度为12mol/L.
| 8.7g |
| 87g/mol |
MnO2+4HCl(浓)
| ||
1 4 22.4L
0.1mol y x
| 1 |
| 0.1 |
| 22.4L |
| x |
| 1 |
| 0.1mol |
| 4 |
| y |
解得x=2.24L,y=0.4mol,
答:产生的氯气在标准状况下的体积为2.24L,参加反应的HCl物质的量有0.4mol;
②加入足量AgNO3溶液,生成沉淀57.4g,沉淀为AgCl,结合Cl原子守恒可知,n(HCl)=2n(Cl2)+n(AgCl),
n(AgCl)=
| 57.4g |
| 143.5g/mol |
n(HCl)总=0.4mol+0.1mol×2=0.6mol,则c(HCl)=
| 0.6mol |
| 0.05L |
答:原浓盐酸的物质量浓度为12mol/L.
点评:本题考查化学反应方程式的计算,为高频考点,把握方程式计算的格式及对应关系为解答的关键,侧重分析能力及计算能力的考查,注意原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列说法错误的是( )
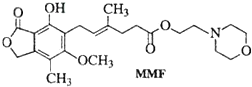

| A、MMF难溶于水 |
| B、MMF能发生氧化反应和消去反应 |
| C、MMF与浓溴水反应,但不能产生白色沉淀 |
| D、1mol MMF最多能与含3mol NaOH的水溶液反应 |
下列物质既是钠盐,又是硫酸盐的是( )
| A、NaOH |
| B、Na2SO4 |
| C、Na2CO3 |
| D、K2CO3 |
有关粒子在相应条件下能大量共存的是( )
| A、常温常压下混合气体:H2、F2、NO、O2 |
| B、能溶解Al2O3的溶液:NH4+、K+、Cl-、CO32- |
| C、c(H+)=1.0 mol?L-1的溶液中:K+、Fe3+、SO42-、I- |
| D、澄清透明的溶液中:Na+、K+、MnO4-、[Al(OH)4]- |

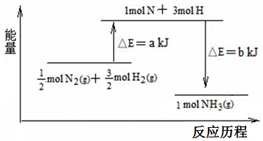 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.