题目内容
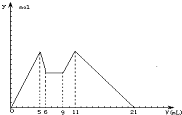 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
考点:镁、铝的重要化合物
专题:图示题
分析:A.根据铝元素守恒计算氢氧化钠与盐酸浓度的关系;
B.根据第一次沉淀最大到最小需要的氢氧化钠的量计算铝离子的物质的量,根据需要氢氧化钠总的物质的量计算镁离子的物质的量,根据电荷守恒计算氯离子的物质的量;
C.假设法分析:若NaOH和盐酸的分界点是6mL处,在6ml处又会沉淀增加,与图象不符;
D.根据沉淀的量未发生变化确定反应实质,从而确定离子方程式.
B.根据第一次沉淀最大到最小需要的氢氧化钠的量计算铝离子的物质的量,根据需要氢氧化钠总的物质的量计算镁离子的物质的量,根据电荷守恒计算氯离子的物质的量;
C.假设法分析:若NaOH和盐酸的分界点是6mL处,在6ml处又会沉淀增加,与图象不符;
D.根据沉淀的量未发生变化确定反应实质,从而确定离子方程式.
解答:
解:A.根据加入前6mL试剂时,先有沉淀生成而后溶解,所以,试剂A是NaOH,则B是盐酸;又由图可知,5→6(1mL)为Al(OH)3的溶解,发生反应:Al(OH)3↓+NaOH=NaAlO2+2H2O,9→11(2 mL)为AlO2-恰好完全生成Al(OH)3沉淀:发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl.根据铝元素守恒知:NaOH~Al(OH)3~AlO2-~H+
1 1 1 1
由此可以推出:n(NaOH)=n(HCl)又因为v(NaOH):v(HCl)=1:2,所以:c(NaOH):c(HCl)=2:1,故A正确;
B.设氢氧化钠的浓度为1mol/l,从加入5mLA生成沉淀最多,再继续加1mLA沉淀量减少到最小值,滴加氢氧化钠在5→6(1 mL)时相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n[Al(OH)3]=(1×6×10-3)mol;由前5mLNaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3)mol,溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B正确.
C.滴加到6ml氢氧化钠时反应Al(OH)3+OH-=AlO2-+2H2O发生完,若此时由滴加氢氧化钠改为滴加盐酸,立刻发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成沉淀,即沉淀的量增加,与图象不符,滴加的氢氧化钠应该大于6ml;设又滴加了xml氢氧化钠,由A知c(NaOH):c(HCl)=2:1,则中和氢氧化钠用HCl为2xml,由图象可以看出共加入NaOH和盐酸9ml(6ml~9ml),故x=1,即NaOH和盐酸的分界点应该是7mL处,故C错误;
D.C中已分析:在7mL处由原来的滴加NaOH,改为滴加盐酸,由图象知7mL~9mL时对应液体中沉淀量不变,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故D正确;
故选C.
1 1 1 1
由此可以推出:n(NaOH)=n(HCl)又因为v(NaOH):v(HCl)=1:2,所以:c(NaOH):c(HCl)=2:1,故A正确;
B.设氢氧化钠的浓度为1mol/l,从加入5mLA生成沉淀最多,再继续加1mLA沉淀量减少到最小值,滴加氢氧化钠在5→6(1 mL)时相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n[Al(OH)3]=(1×6×10-3)mol;由前5mLNaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3)mol,溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B正确.
C.滴加到6ml氢氧化钠时反应Al(OH)3+OH-=AlO2-+2H2O发生完,若此时由滴加氢氧化钠改为滴加盐酸,立刻发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成沉淀,即沉淀的量增加,与图象不符,滴加的氢氧化钠应该大于6ml;设又滴加了xml氢氧化钠,由A知c(NaOH):c(HCl)=2:1,则中和氢氧化钠用HCl为2xml,由图象可以看出共加入NaOH和盐酸9ml(6ml~9ml),故x=1,即NaOH和盐酸的分界点应该是7mL处,故C错误;
D.C中已分析:在7mL处由原来的滴加NaOH,改为滴加盐酸,由图象知7mL~9mL时对应液体中沉淀量不变,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故D正确;
故选C.
点评:本题考查了镁、铝重要化合物的性质,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应 Al2O3+N2+C→AlN+CO (未配平)合成.下列叙述正确的是( )
| A、上述反应中,1mol N2被氧化时,可以得到6mol电子 |
| B、上述反应中,被氧化与被还原的物质 物质的量之比为2:3 |
| C、每生成1mol AlN时.消耗N2的质量为14g |
| D、AlN的摩尔质量为41g |
一定能在下列无色溶液中大量共存的离子组是( )
| A、c(H+)=1×10-13mol?L-1的溶液:Na+、Ba2+、HCO3-、SO42- |
| B、加入铝单质能产生大量氢气的溶液:Na+、NO3-、SO42-、Cl- |
| C、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| D、在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42-、Cl- |
酸碱恰好完全中和时( )
| A、酸与碱的物质的量一定相等 |
| B、溶液呈现中性 |
| C、酸与碱的物质的量浓度相等 |
| D、酸所能提供的H+与碱所能提供的OH-的物质的量相等 |
下列叙述正确的是 ( )
| A、0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 |
| D、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
下列叙述仪器“O”刻度位置正确的是( )
| A、在量筒的下端 |
| B、在普通温度计的中间 |
| C、在托盘天平标尺的正中 |
| D、在容量瓶的颈部 |
反应2A(气)?2B(气)+C(气);△Η>0,在未用催化剂的条件下已达到平衡,现要使正反应速率降低,[B]减小,应采用的措施( )
| A、升温 | B、增大反应器体积 |
| C、增大c(A) | D、降温 |
某同学做完Zn-Cu-H2SO4组成的原电池的实验后,在读书卡片上作了如下记录,其中合理的是( )

| A、①②③ | B、④⑤⑥ |
| C、③④⑤ | D、②③⑥ |
 分子中不含有的基团是( )
分子中不含有的基团是( )| A、甲基 | B、羟基 | C、羧基 | D、醛基 |