题目内容
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应 Al2O3+N2+C→AlN+CO (未配平)合成.下列叙述正确的是( )
| A、上述反应中,1mol N2被氧化时,可以得到6mol电子 |
| B、上述反应中,被氧化与被还原的物质 物质的量之比为2:3 |
| C、每生成1mol AlN时.消耗N2的质量为14g |
| D、AlN的摩尔质量为41g |
考点:氧化还原反应,镁、铝的重要化合物
专题:氧化还原反应专题
分析:该反应中N元素化合价由0价变为-3价、C元素化合价由0价变为+2价,得失电子总数为6,再结合原子守恒配平方程式为Al2O3+N2+3C=2AlN+3CO,该反应中氧化剂是氮气、还原剂是C,据此分析解答.
解答:
解:该反应中N元素化合价由0价变为-3价、C元素化合价由0价变为+2价,得失电子总数为6,再结合原子守恒配平方程式为Al2O3+N2+3C=2AlN+3CO,该反应中氧化剂是氮气、还原剂是C,
A.氮气是氧化剂,在反应中被还原,故A错误;
B.氧化剂是氮气、还原剂是C,则被氧化与被还原的物质的量之比为3:1,故B错误;
C.每生成1mol AlN时,根据氮原子守恒知,消耗氮气的物质的量为0.5mol,氮气质量为14g,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误;
故选C.
A.氮气是氧化剂,在反应中被还原,故A错误;
B.氧化剂是氮气、还原剂是C,则被氧化与被还原的物质的量之比为3:1,故B错误;
C.每生成1mol AlN时,根据氮原子守恒知,消耗氮气的物质的量为0.5mol,氮气质量为14g,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误;
故选C.
点评:本题考查了氧化还原反应,根据转移电子相等配平方程式,再结合方程式中各个物理量之间的关系分析解答,易错选项是A,注意氧化剂在反应中被还原而不是被氧化,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列两种气体的体积一定相等的是( )
| A、质量相等,密度相等的Cl2和NH3 |
| B、同温同质量的CO和C2H4 |
| C、同温同压下同质量的CO2和SO2 |
| D、同压同质量的C3H6和CO2 |
下列有关金属的工业制法中,正确的是( )
| A、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| B、制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
| C、制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 |
| D、制铁:以铁矿石为原料,CO还原得铁 |
下列离子方程式正确的是( )
| A、向小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O |
| B、氢氧化镁与稀硫酸反应:H++OH-=H2O |
| C、钠与水反应,有氢气产生:Na+H2O=Na++OH-+H2↑ |
| D、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
下列说法中正确的是( )
| A、含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B、pH相等的NaOH、NaHCO3和Na2CO3三种溶液:c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C、常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D、某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a:b=2:9 |
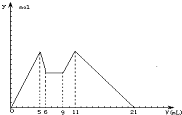 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表: 总反应:Zn+Cu2+=Zn2++Cu.
总反应:Zn+Cu2+=Zn2++Cu.