题目内容
反应2A(气)?2B(气)+C(气);△Η>0,在未用催化剂的条件下已达到平衡,现要使正反应速率降低,[B]减小,应采用的措施( )
| A、升温 | B、增大反应器体积 |
| C、增大c(A) | D、降温 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,使c(B)减小,应使平衡向逆反应方向移动,以此解答该题.
解答:
解:A.升高温度,反应速率增大,平衡向正向移动,c(B)增大,故A错误;
B.增大反应器体积,气体浓度减小,反应速率减小,平衡向正反应方向移动,但c(B)减小,故B正确;
C.增大c(A),反应速率增大,故C错误;
D.降温,反应速率减小,平衡向逆向移动,c(B)减小,故D正确.
故选BD.
B.增大反应器体积,气体浓度减小,反应速率减小,平衡向正反应方向移动,但c(B)减小,故B正确;
C.增大c(A),反应速率增大,故C错误;
D.降温,反应速率减小,平衡向逆向移动,c(B)减小,故D正确.
故选BD.
点评:本题考查外界条件对化学平衡的影响,为高频考点,侧重于学生的分析能力的考查,难度不大,本题注意根据反应方程式的特征判断平衡移动的方向.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、向小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O |
| B、氢氧化镁与稀硫酸反应:H++OH-=H2O |
| C、钠与水反应,有氢气产生:Na+H2O=Na++OH-+H2↑ |
| D、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
反应2NO2(g)?2NO(g)+O2(g);△H>0,密闭容器中进行,并达到平衡.要使体系中气体颜色加深,正反应速率降低,应采用的措施是( )
| A、加压 | B、减压 |
| C、降温 | D、充入氧气 |
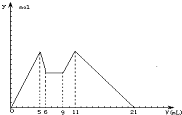 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
有NaCl和MgCl2组成的混合物153.5g,溶于水配成1L溶液,此溶液中Cl-的物质的量浓度为3mol/L,则原混合物中的MgCl2的质量为( )
| A、95g | B、47.5g |
| C、58.5g | D、117g |
化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A、苏打-NaHCO3 |
| B、胆矾-CuSO4 |
| C、酒精-CH3OH |
| D、生石灰-CaO |
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法正确的是( )

| A、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、C(s、石墨)═C(s、金刚石)△H=+1.9kJ?mol-1 |
能在水溶液中大量共存的一组离子是( )
| A、H+、Fe3+、I-、SO42- |
| B、Al3+、Mg2+、HCO3-、Cl- |
| C、K+、Ag+、Ca2+、PO43- |
| D、NH4+、Na+、SO42-、Cl- |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
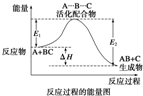

A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |