题目内容
18.下列实验设计、操作或实验现象不合理的是( )| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 检验蔗糖水解产物,可向水解样品中直接加入银氨溶液做银镜反应的实验 | |
| D. | 钠和乙醇的反应现象,钠沉在试管底部,有气泡,反应缓慢 |
分析 A.实验中常用饱和食盐水代替水,目的减缓电石与水的反应速率;
B.苯酚与氢氧化钠溶液反应;
C.检验醛基应在碱性条件下;
D.与水相比较,乙醇密度较小,钠与乙醇反应时,钠沉在乙醇液面的下面,钠与乙醇反应不如钠与水反应剧烈,可生成乙醇钠和氢气,钠的熔点比乙醇的沸点高,钠在乙醇中反应不会熔化成小球.
解答 解:A.由于电石和水的反应很剧烈,所以实验中常用饱和食盐水代替水,目的减缓电石与水的反应速率,故A正确;
B.苯不溶于水,苯酚与氢氧化钠溶液反应,可分液分离,故B正确;
C.应在碱性条件下发生氧化还原反应,应在碱性条件下发生氧化还原反应,故C错误;
D.钠在乙醇液面以下,钠不融化,与乙醇反应,缓缓产生气泡,在钠的表面产生氢气,故D正确.
故选C.
点评 本题考查化学实验方案的设计,为高频考点,涉及有机物的制备与性质、有机物的检验等,把握性质及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
13.下列实验操作、现象和得出的结论均正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
3.对于下列四幅图象的表述正确的是( )
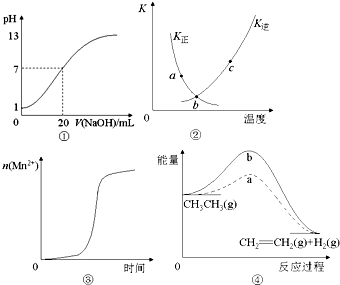

| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
7.下列叙述正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物(包括过氧化物)均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 虽然自然界含钾的物质均易溶于水,但土壤中钾含量太少,故需施用钾肥 |
8.按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L 的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)也增大
C.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 D.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ 减小
(3)①常温下将0.15mol/L稀硫酸V1 mL与0.1mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下,若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCNB.HClOC.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+H2O+CO2
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”“=”或“<”).
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L 的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)也增大
C.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 D.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ 减小
(3)①常温下将0.15mol/L稀硫酸V1 mL与0.1mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下,若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCNB.HClOC.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO D.NaHCO3+HCN═NaCN+H2O+CO2
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
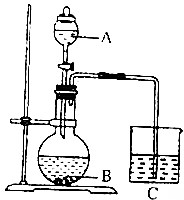 某化学小组设计如图装置完成一组实验;
某化学小组设计如图装置完成一组实验;
 有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:
有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空: