题目内容
9.通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成.下图所示的是用燃烧法确定有机物分子式的常用装置.
现准确称取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
(1)C管中浓硫酸的作用是干燥氧气;
(2)按上述所给的测量信息,装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(3)要确定该有机物的分子式,还必须知道的数据是②(选填序号);
①C装置增加的质量②样品的摩尔质量③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的二氯代物有4种.
分析 (1)(2)实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O),A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入F中的氧气、D用来制取反应所需的氧气、F是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3)该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量;
(4)根据根据元素守恒和质量守恒计算氧原子的物质的量,计算碳、氢、氧原子个数之比确定最简式,结合相对分子质量计算分子式.
解答 解:实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O),A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入F中的氧气、D用来制取反应所需的氧气、F是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2.
(1)C管中浓硫酸的作用是:干燥氧气,故答案为:干燥氧气;
(2)由测定原理可知,所选置的连接顺序应是:D→C→E→B→A,
故答案为:D→C→E→B→A;
(3)A管质量增加0.88g为二氧化碳的质量,可得碳元素的质量:0.88g×$\frac{12}{44}$=0.24g,
B管质量增加0.36g是水的质量,可得氢元素的质量:0.36g×$\frac{2}{18}$=0.04g,
从而可推出含氧元素的质量为:0.44-0.24-0.04=0.16g,
设最简式为CXHYOZ,则:
X:Y:Z=$\frac{0.24}{12}$:$\frac{0.04}{1}$:$\frac{0.16}{16}$=2:4:1,即最简式为C2H4O,
要确定有机物的分子式,还要知道有机物的相对分子质量,
故答案为:②;
(4)该有机物最简式为C2H4O,相对分子质量是22×2=44,最简式即为分子式,它的核磁共振氢谱上有两个峰,其强度比为3:1,则结构简式为CH3CHO,与该有机物相对分子质量相同的烃是C3H8,二氯代物有4种,
故答案为:CH3CHO;4.
点评 本题考查物质组成测定的实验测定,题目难度中等,关键在于清楚实验的原理,掌握燃烧法利用元素守恒确定实验式的方法.

| A. | 常温下,2.24LCH4中含有0.4NA个共价键 | |
| B. | 100mL1mol•L-1NaAlO2溶液中含有0.1NA个AlO2- | |
| C. | 常温常压下,5.6gFe与足量稀硝酸反应,转移电子0.2NA个电子 | |
| D. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 |
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的化学式:NH4+ (用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是H2CO3(填化学式),理由是H2CO3为弱酸,其它三种为强酸.Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为3H++Al(OH)3═Al3++3H2O.
 在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.
在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子方程式:HCO3-+H+═CO2↑+H2O、CO32-+2H+═CO2↑+H2O
②两支试管中的现象为两支试管中都产生气泡,但装有NaHCO3的试管中反应速率快得多
③两试管中气球大小(不包含试管)体积之比约为Ⅰ:Ⅱ=42:53(填最简单整数比)
④甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲得出的结论是否正确不正确.(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的 饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3的 饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为温度计和托盘天平.
通过上述实验可得出三条结论:
a:NaHCO3的溶解是吸热(吸热或放热)过程
b:Na2CO3的饱和溶液和盐酸的反应是放热(吸热或放热)反应;
C:NaHCO3的饱和溶液和盐酸的反应是吸热(吸热或放热)反应.
| A. | 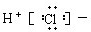 | B. | 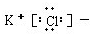 | C. | Cl:Cl | D. | 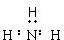 |
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 检验蔗糖水解产物,可向水解样品中直接加入银氨溶液做银镜反应的实验 | |
| D. | 钠和乙醇的反应现象,钠沉在试管底部,有气泡,反应缓慢 |
| A. | 3,4-二甲基-4-乙基庚烷 | B. | 3,5-二甲基-3-庚烯 | ||
| C. | 3-乙基-1-辛烯 | D. | 2,4,4-三甲基戊烷 |