题目内容
H2SO4的摩尔质量为 ,1.204×1024个H2SO4分子物质的量为 ,所含电子物质的量为 ,共含 个氧原子.
考点:物质的量的相关计算,物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:H2SO4的摩尔质量在数值上等于H2SO4的相对分子质量,根据n=
结合物质的构成计算.
| N |
| NA |
解答:
解:H2SO4的摩尔质量为98 g?mol-1,n(H2SO4)=
=2mol,所含电子物质的量为2mol×(2×1+16+8×4)=100mol,
N(O)=2mol×4×6.02×1023/mol=4.816×1024,
故答案为:98 g?mol-1;2 mol;100 mol;4.816×1024.
| 1.204×1024 |
| 6.02×1023/mol |
N(O)=2mol×4×6.02×1023/mol=4.816×1024,
故答案为:98 g?mol-1;2 mol;100 mol;4.816×1024.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
下列实验中,能够达到实验目的是( )
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、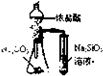 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |
(双项)已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由氢原子和氯原子形成1mol HCl时释放431kJ的能量.下列叙述正确的是( )
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)═2HCl(g) |
| B、氢气与氯气反应生成2mol的氯化氢气体,反应的△H=183 kJ?mol-1 |
| C、氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183 kJ?mol-1 |
| D、氢气与氯气反应生成1mol氯化氢气体,反应的△H=-91.5 kJ?mol-1 |
有关电解质的下列叙述中正确的是( )
| A、盐酸的导电性比乙酸溶液的导电性强,说明乙酸是弱酸 |
| B、因为氧化钾溶于水能导电,所以氧化钾是电解质 |
| C、强电解质中一定含有离子键,弱电解质中一定含有弱极性共价键 |
| D、某物质能导电,说明该物质一定含有能自由移动的带电荷的微粒 |
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为( )
| A、0.15 mol/L |
| B、0.10 mol/L |
| C、0.25 mol/L |
| D、0.20 mol/L |
 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题:
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.回答下列问题: