��Ŀ����
14���ȣ�38Sr��Ԫ�ع㷺�����ڿ�Ȫˮ�У���һ������������Ԫ�أ���Ԫ�����ڱ�����20Ca��56Baͬ���ڵڢ�A�壮��1�����ԣ�Sr��OH��2�� Ba��OH��2����������������ȵĻ�ѧ������ƺͱ����ƣ���ԭ�ӽṹ�Ĺ۵������ԭ����ͬһ����Ԫ�أ�ԭ��������������ͬ��
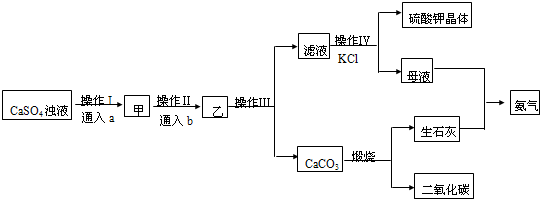
��2��̼����������Ҫ���Ȼ�����ú�SrSO4������BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2������ʯ�Ʊ�SrCO3�������������£����ֲ����������ԣ���
������ʯ��ۺ�Na2CO3��Һ��ֻ�ϣ����ˣ�
�������������ᣬ���ˣ�
�����������Һ�м���Ũ���ᣬ���ˣ�
�������������Һ���ȼ�������ᣬ��ַ�Ӧ�����ð�ˮ��pHԼΪ7�����ˣ�
�������������Һ�м����Թ���NH4HCO3����ַ�Ӧ���ˣ�������ϴ������ɣ��õ�SrCO3��
��֪��������ͬ�¶�ʱ���ܽ�ȣ�BaSO4��SrCO3��SrSO4��CaSO4
���������������������pH
| ���� | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ����pH | 1.9 | 7.0 | 3.4 |
| ��ȫ����pH | 3.2 | 9.0 | 4.7 |
�ڢ��У��������ᷴӦ�ܽ��������SrCO3��BaCO3��FeO��Fe2O3��Al2O3��
�ۢ���Ŀ���ǽ�Fe2+����ΪFe3+��ʹFe3+��Al3+������ȫ��
�����й��ڸù������̵�˵����ȷ����ac��
a���ù��ղ����ķ�Һ���϶��NH4+��Na+��Cl-��SO42-
b�����з�Ӧʱ�������¶�һ���������SrCO3����������
c�����з�Ӧʱ��������Һһ���������NH4HCO3�������ʣ�
���� ��1��ͬһ����Ԫ�أ�Ԫ�صĽ���������ԭ�������������ǿ��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ��
ͬһ����Ԫ�أ���������������ȣ�Ԫ������ȡ���ڼ۵��ӣ�
��2���ú�SrSO4������BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2������ʯ�Ʊ�SrCO3�������������£����ֲ����������ԣ���
����ͬ�¶�ʱ�ܽ��SrCO3��SrSO4���ܽ�ȴ��������ת��Ϊ�ܽ��С�����ʣ����Խ�����ʯ��ۺ�Na2CO3��Һ��ֻ�ϣ������ķ�ӦΪSrSO4+Na2CO3=SrCO3+Na2SO4��Ȼ����ˣ�
����������SrCO3��BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2���������������ᣬ�ܺ�ϡ���ᷴӦ��������̼���Ρ����������Ȼ����ˣ�
�����������Һ�м���Ũ���ᣬ�ܺ�Ũ���ᷴӦ��Ϊ�����ӣ��������ᱵ������Ȼ����ˣ�
�������������Һ���ȼ�������ᣬ���������ǿ�����ԣ��ܽ����������������������ӣ���ַ�Ӧ�����ð�ˮ��pHԼΪ7���������������������pH֪���õ��ij�����Fe��OH��3��Al��OH��3��Ȼ����ˣ�
�������������Һ�м����Թ���NH4HCO3���������ֽⷴӦ���ɳ���SrCO3����ַ�Ӧ���ˣ�������ϴ������ɣ��õ�SrCO3��
��SrSO4��̼������Һ��Ӧ������ת����ʵ�����ܽ�ƽ����ƶ���������ʯ��ĩ��̼������Һ�Ļ������90��ʱ����1��2h�������ˡ�ϴ�ӣ��õ�̼���ȣ�˵��̼���ȵ��ܽ��С�������ȵ��ܽ�ȣ�
��SrCO3��BaCO3��FeO��Fe2O3��Al2O3�������ᷴӦ��
���ȼ�������ᣬ�����������ӣ����ð�ˮ��pHԼΪ7��ʹ�����ӡ�������ת��Ϊ������
��a���������̿�֪�ù��ղ����ķ�Һ���϶��NH4+��Na+��SO42-��Cl-��
b�������¶ȴٽ�̼�����ˮ���̼�����Ũ�Ƚ��ͣ�ƽ�������ƶ���
c������ʱ������������̼����立�Ӧʱ����һ������Ӧ���ɵ�һˮ�ϰ���̼����淋ķ�Ӧ���˷���һ����̼����泥����������Һ����Ӱ�췴Ӧ���̵��ǻ�ϡ��һˮ�ϰ���Ũ�ȣ�ʹ�ø���Ӧ������ռ�ı����Ӷ����٣�Ҳ���������̼����淋������ʣ�
��� �⣺��1��ͬһ����Ԫ�أ�Ԫ�صĽ���������ԭ�������������ǿ��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ��
ͬһ����Ԫ�أ���������������ȣ�Ԫ������ȡ���ڼ۵��ӣ�
������Sr��Ba������ԣ�Sr��OH��2��Ba��OH��2���ȵĻ�ѧ������ƺͱ����ƣ�����ͬһ����Ԫ�أ�ԭ��������������ͬ��
�ʴ�Ϊ������ͬһ����Ԫ�أ�ԭ��������������ͬ��
��2���ú�SrSO4������BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2������ʯ�Ʊ�SrCO3�������������£����ֲ����������ԣ���
����ͬ�¶�ʱ�ܽ��SrCO3��SrSO4���ܽ�ȴ��������ת��Ϊ�ܽ��С�����ʣ����Խ�����ʯ��ۺ�Na2CO3��Һ��ֻ�ϣ������ķ�ӦΪSrSO4+Na2CO3=SrCO3+Na2SO4��Ȼ����ˣ�
����������SrCO3��BaSO4��BaCO3��FeO��Fe2O3��Al2O3��SiO2���������������ᣬ�ܺ�ϡ���ᷴӦ��������̼���Ρ����������Ȼ����ˣ�
�����������Һ�м���Ũ���ᣬ�ܺ�Ũ���ᷴӦ��Ϊ�����ӣ��������ᱵ������Ȼ����ˣ�
�������������Һ���ȼ�������ᣬ���������ǿ�����ԣ��ܽ����������������������ӣ���ַ�Ӧ�����ð�ˮ��pHԼΪ7���������������������pH֪���õ��ij�����Fe��OH��3��Al��OH��3��Ȼ����ˣ�
�������������Һ�м����Թ���NH4HCO3���������ֽⷴӦ���ɳ���SrCO3����ַ�Ӧ���ˣ�������ϴ������ɣ��õ�SrCO3��
��I��ֻ��SrSO4��̼������Һ��Ӧ����ӦΪSrSO4+Na2CO3=SrCO3+Na2SO4��ƽ��������У�����̼������Һ��ƽ��������У��ڷ�Ӧ�����в��Ͻ��������߷�Ӧ�����ʺ�Ч��
�ʴ�Ϊ��̼���ȵ��ܽ��С�������ȵ��ܽ�ȣ����裻�ʴ�Ϊ��SrSO4+Na2CO3=SrCO3+Na2SO4�� ����̼������Һ�����裻
�������ʵ��ܽ��Կ�֪��ֻ��̼���κͽ��������������ᷴӦ����SrCO3��BaCO3��FeO��Fe2O3��Al2O3�������ᷴӦ��
�ʴ�Ϊ��SrCO3��BaCO3��FeO��Fe2O3��Al2O3��
���������������������pH��֪������Ŀ���ǽ�Fe2+����ΪFe3+��ʹFe3+��Al3+������ȫ���ʴ�Ϊ����Fe2+����ΪFe3+��ʹFe3+��Al3+������ȫ��
��a���������̿�֪�ù��ղ����ķ�Һ���϶��NH4+��Na+��SO42-��Cl-����a��ȷ��
b�������¶ȴٽ�̼�����ˮ���̼�����Ũ�Ƚ��ͣ�ƽ�������ƶ����������SrCO3���������ʣ���b����
c������ʱ������������̼����立�Ӧʱ����һ������Ӧ���ɵ�һˮ�ϰ���̼����淋ķ�Ӧ���˷���һ����̼����泥����������Һ����Ӱ�췴Ӧ���̵��ǻ�ϡ��һˮ�ϰ���Ũ�ȣ�ʹ�ø���Ӧ������ռ�ı����Ӷ����٣�Ҳ���������̼����淋������ʣ���c��ȷ��
�ʴ�Ϊ��ac��
���� ���⿼���Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬�漰�������������ʵķ�����ᴿ��������ԭ��Ӧ��֪ʶ�㣬��ȷ�������跢���ķ�Ӧ����Һ�д��ڵ����ɷ��ǽⱾ��ؼ����ѵ����жϸ���������Һ�гɷ֣���Ŀ�Ѷ��еȣ�

| A�� | 18g H2O����NA����ԭ�� | |
| B�� | 1.6g����������ԭ�ӵ���ĿΪ0.1NA | |
| C�� | 1mol CO2�к���ԭ����ΪNA | |
| D�� | ��NA���Ƶ�Na2SO4�����ʵ�����1mol |
| A�� | ��״���£�22.4Lˮ������ԭ����ĿΪ3NA | |
| B�� | һ�������£������ʵ��������һ����̼�����ķ��������ܲ���� | |
| C�� | 1Lһ����̼����һ����1L����������С | |
| D�� | ��״���£�17g���������ԼΪ22.4L |
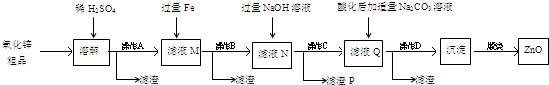
��Ӧ�漰�ļ������ʵ��۷е����£�
| ���� | S | S2Cl2 |
| �е�/�� | 445 | 138 |
| �۵�/�� | 113 | -76 |
 ��С����Ƶ��Ʊ�װ����ͼ���г���������ȥ�����ش��������⣺
��С����Ƶ��Ʊ�װ����ͼ���г���������ȥ�����ش��������⣺��1�����Ӻ�ʵ��װ�ú�ĵ�һ��ʵ������Ǽ��װ�õ������ԣ�
��2��ʵ������Ҫ���ȵ�������AD������д��ĸ��
��3��װ��B��C�е��Լ��ֱ��DZ���ʳ��ˮ��Ũ���ᣮ
��4��װ��D������a������������������������
��5����Ӧ���������ƿ�ڻ�����з������Ʒ�ķ���������
��6����ʵ�������ȱ��Cװ�ã����ֲ�Ʒ���Dz��壬���û�ѧ����ʽ��ʾ��ԭ��2S2Cl2+2H2O=3S��+SO2��+4HCl��
��7��ʵ����ϣ�С���е�һλͬѧ��ʣ��Ũ���ᵹ��E�ձ��У������л���ɫ�ݼ����� ������������ӷ���ʽ��ʾ�����������ԭ��ClO-+2H++Cl-=Cl2��+H2O��

��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO2•3H2O��
�ڳ����£�Ksp��FeS��=6.3��10-18��Ksp��CuS��=6.3��10-28��Ksp��PbS��=2.4��10-28
��1����ӦI�з�����Ӧ�����ӷ���ʽΪSO32-+2ClO3-+2H+=2C1O2+SO42-+H2O��
��2������Һ�еõ�NaClO2•3H2O������������������bdc����д��ţ���
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ�����������ƣ�NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2���±���25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
| ���� | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1��10-2 | 6.3��10-4 | K1=4.30��10-7 K2=5.60��10-11 | K1=9.1��10-8 K2=l.1��10-12 |
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij�����CuS�������£������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10-5mol•L-1����ʱ��ϵ�е�S2-��Ũ��Ϊ6.3��10-13mol/L��
��4����װ������������a�ĵ缫��Ӧʽ2H2O-4e-=O2��+4H+������������a�����Ϊ1.12L����״��������ת�Ƶ��ӵ����ʵ���Ϊ0.2mol��
| A�� | �����ķ���ʽ��N��N | B�� | Na+�ṹʾ��ͼ�ǣ�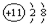 | ||
| C�� | �Ҵ��Ľṹ��ʽC2H6O | D�� | HClO�ĵ���ʽ��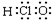 |