题目内容
4.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;
(2)计算H2和C3H8的平均燃烧热,根据十字交叉法计算H2和C3H8的体积比即可.
解答 解:(1)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
②H2O(1)=H2O(g);△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol,
答:丙烷燃烧生成CO2和气态水的热化学方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol;
(2)由热化学方程式可知,氢气的燃烧热为285.8kJ/mol,丙烷的燃烧热为2220.0kJ/mol,H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5KJ,则混合气体中H2和C3H8的平均燃烧热为$\frac{6262.5KJ}{5mol}$=1252.5kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
故H2和C3H8的体积比为967.5kJ/mol:966.7kJ/mol=1:1.
答:混合气体中H2和C3H8的体积比为1:1.
点评 本题考查反应热的计算、盖斯定律等,难度中等,(1)中利用十字交叉法计算,比常规方法简单,容易计算,注意对十字交叉法的理解.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
14.下列物质命名正确的是( )
| A. | 1,3-二甲基丁烷 | B. | 2,3-二甲基-2-乙基己烷 | ||
| C. | 2,3-二甲基-4-乙基戊烷 | D. | 2,3,5-三甲基己烷 |
12.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 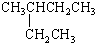 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 | D. | 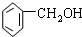 苯甲醇 |
19.下列有关溶液中各类平衡的说法正确的是( )
| A. | 一定温度下,稀释0.1mol/L的CH3COOH溶液,KW不变,Ka将增大 | |
| B. | 对FeCl3溶液进行稀释时,Fe3+水解程度将增大,故溶液的酸性将增强 | |
| C. | 可根据Ksp的数值大小直接比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,有黄色沉淀生成 |
16.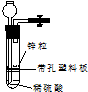 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
①NaNO3溶液;②酒精;③CCl4;④苯;⑤Na2CO3溶液;⑥KCl溶液.
 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )①NaNO3溶液;②酒精;③CCl4;④苯;⑤Na2CO3溶液;⑥KCl溶液.
| A. | ①②③ | B. | ②④⑤ | C. | ①②④⑥ | D. | ②③⑥ |
13.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO42-$→_{转换}^{H+}$Cr2O72- $→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓ 己知转化过程中的反应为:2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-.下列说法不正确的是( )
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |

 .
.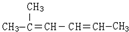 名称为:2-甲基-2,4-己二烯;
名称为:2-甲基-2,4-己二烯; ,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3
,一个-Br,则A的结构简式为(CH3)2CHCHBrCH3