题目内容
19.下列有关溶液中各类平衡的说法正确的是( )| A. | 一定温度下,稀释0.1mol/L的CH3COOH溶液,KW不变,Ka将增大 | |
| B. | 对FeCl3溶液进行稀释时,Fe3+水解程度将增大,故溶液的酸性将增强 | |
| C. | 可根据Ksp的数值大小直接比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,有黄色沉淀生成 |
分析 A.温度一定离子积常数和电离平衡常数不变,弱电解质存在电离平衡,加水稀释促进电离;
B.氯化铁溶液中铁离子水解溶液显酸性,加入水稀释促进水解,离子浓度减小;
C.比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,比较同类型的难溶物的溶解度大小,可通过溶度积直接比较溶解度大小;
D.反应向着更难溶的方向进行.
解答 解:A.温度一定离子积常数和电离平衡常数不变,弱电解质存在电离平衡,加水稀释促进电离,一定温度下,稀释0.1mol/L的CH3COOH溶液,KW不变,Ka不变,故A错误;
B.氯化铁溶液中铁离子水解溶液显酸性,加入水稀释促进水解,离子浓度减小,酸性减弱,故B错误;
C.阴阳离子之比相同的难溶物可以用溶度积常数比较溶解性,比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,故C错误;
D.25℃时,Ksp(AgCl)>Ksp(AgI),说明氯化银溶解度小于碘化银,向AgCl悬浊液中加入KI固体,有黄色沉淀碘化银生成,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、盐类水解、沉淀溶解平衡的影响因素分析,注意平衡常数随温度变化,题目难度中等.

练习册系列答案
相关题目
9.下面有关化学反应速率和限度的图象和实验结论表达均正确的是( )


| A. | 图①是其他条件一定时反应速率随温度变化的图象,图象表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移 | |
| B. | 图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化 | |
| C. | 图③可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响 | |
| D. | 图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
10.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是放热反应(填“放热”或“吸热”),该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,.
(2)能判断该反应是否达到化学平衡状态的依据是bc(填序号)
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为C.
A.加压,400~500℃催化剂 B.加压,830~1000℃催化剂
C.常压,400~500℃催化剂D.常压,830~1000℃催化剂
(4)在830℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10min后达到平衡时,CO2的平衡浓度为1.2mol/L,用H2浓度变化来表示的平均反应速率为0.12mol/(L•min),CO的转化率是60%.
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是a(填字母序号)
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂.
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是放热反应(填“放热”或“吸热”),该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,.
(2)能判断该反应是否达到化学平衡状态的依据是bc(填序号)
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为C.
A.加压,400~500℃催化剂 B.加压,830~1000℃催化剂
C.常压,400~500℃催化剂D.常压,830~1000℃催化剂
(4)在830℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10min后达到平衡时,CO2的平衡浓度为1.2mol/L,用H2浓度变化来表示的平均反应速率为0.12mol/(L•min),CO的转化率是60%.
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是a(填字母序号)
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂.
7.利用图装置进行实验,甲乙两池均为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+浓度越大,氧化性越强).
下列说法不正确的是( )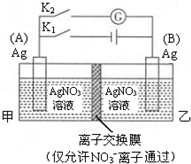
下列说法不正确的是( )

| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
14.下列反应中属于消去反应的是( )
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |
11.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.
8.下列事故处理的方法中不正确的是( )
| A. | 电器起火,立即用水扑灭 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书管内图书着火,立即用液态二氧化碳灭火器扑灭 |
9.下列有关说法不正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |