题目内容
16.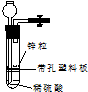 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )①NaNO3溶液;②酒精;③CCl4;④苯;⑤Na2CO3溶液;⑥KCl溶液.
| A. | ①②③ | B. | ②④⑤ | C. | ①②④⑥ | D. | ②③⑥ |
分析 在实验室中发现酸液不足而又无其他酸液可加入实现制取氢气,则加入试剂为水溶液或与酸不反应不互溶且密度比水大的有机溶剂,以此来解答.
解答 解:①NaNO3溶液在酸性条件下与Zn反应不生成氢气,故错误;
②酒精可使液体总体积变大,Zn与稀硫酸接触而制取氢气,故正确;
③CCl4与硫酸不反应且密度比硫酸密度大,Zn与稀硫酸接触而制取氢气,故正确;
④苯的密度比硫酸密度小,隔绝Zn与稀硫酸,不能制备氢气,故错误;
⑤Na2CO3溶液与硫酸反应生成二氧化碳,不利于制备氢气,故错误;
⑥KCl溶液可使液体总体积变大,Zn与稀硫酸接触而制取氢气,故正确;
故选D.
点评 本题考查实验装置综合应用及物质的性质,为高频考点,把握制备氢气的反应原理、物质的性质为解答的关键,侧重分析与应用能力的考查,注意硝酸钠为解答的难点,题目难度不大.

练习册系列答案
相关题目
7.利用图装置进行实验,甲乙两池均为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+浓度越大,氧化性越强).
下列说法不正确的是( )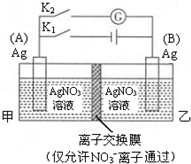
下列说法不正确的是( )

| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
11.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:
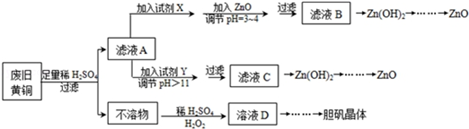
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.
1.下列各组物质反应时,改变反应条件或者反应物的物质的量之比,生成的产物不变的是( )
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | Al与稀盐酸 | D. | KHCO3与Ba(OH)2 |
8.下列事故处理的方法中不正确的是( )
| A. | 电器起火,立即用水扑灭 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书管内图书着火,立即用液态二氧化碳灭火器扑灭 |
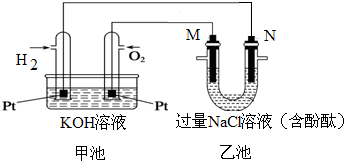 如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:
如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题: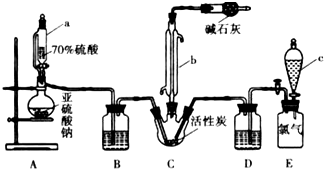 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示: