题目内容
13.硫及其化合物对人类生活有重要影响.回答下列问题:(1)H2S可用于生产重要有机溶剂二甲基亚砜[(CH3)2SO],反应的方程式为:
①2CH3OH+H2S(g)$\frac{\underline{\;r-Al_{2}O_{3}\;}}{400℃}$(CH3)2S(g)+2H2O(g)△H1
②(CH3)2S(g)+NO2(g)═(CH3)2SO(g)+NO(g)△H2
③2NO(g)+O2(g)═2NO2(g)△H3
则由H2S生成l mol二甲基亚砜的△H=△H1+△H2+$\frac{1}{2}$△H3(用△H1、△H2、△3示);
上述反应中可循环利用的物质为NO2.
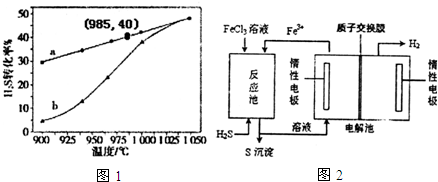
(2)高温热分解法可制取单质硫.已知:2H2S(g)?2H2(g)+S2(g).在容积为2L的密闭容器中充入10mol H2S,H2S分解转化率随温度变化的曲线如图1所示.图中a为H2S的平衡转化率与温度关系曲线,b为不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.则985℃时H2S按上述反应分解的平衡常数K=0.44;随温度的升高,曲线b向曲线a逼近的原因是温度升高,反应速率加快,达到平衡所需时间缩短.
上述反应中,正反应速率为v正=k正x2(H2S),逆反应速率为v逆=k逆x2(H2)x(S2),其中k正、k逆为速率常数,则k逆=$\frac{k{\;}_{正}}{k}$(以K和k正表示).
(3)用图2装置可实现H2S的绿色转化.
①反应池中反应的离子方程式是H2S+2Fe3+=2Fe2++S↓+2H+.
②反应后的溶液进入电解池,电解总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑.
(4)将标况下3.36L H2S气体缓慢通入100mL 3.0mol•-1NaOH溶液中充分反应得到溶液M,将溶液M滴入ZnSO4和CuSO4的混合溶液N中,当ZnS开始沉淀时,溶液N中c(Cu2+)/c(Zn2+)=6.5×10-15.(已知:Ksp(ZnS)=2.0×10-22,Ksp(CuS)=1.3×10-36.)
分析 (1)利用盖斯定律,将①×2+②×2+③可得反应2H2S(g)+4CH3OH(l)+O2(g)=2(CH3)2SO(l)+2H2O(g);根据题中的三个反应可知,二氧化氮氧化(CH3)2S,得到一氧化氮,一氧化氮又被氧化成二氧化氮,据此判断;
(2)根据题意,H2S起始浓度为5mol•L-1,985℃时H2S的转化率为40%,利用三段式可计算出平衡时各物质的浓度,进而确定平衡常数;根据温度对速率的影响分析;当反应处于平衡状态时v正=v逆,结合平衡常数进行计算;
(3)根据装置图可知,①反应池中用铁离子将硫化氢氧化成硫,铁离子被还原成亚铁离子;
②反应后的溶液为氯化亚铁溶液,电解氯化亚铁时,阳极上亚铁离子被氧化成铁郭,阴极上水中的氢离子被还原成氢气,据此书写电解方程式;
(4)根据c(Cu2+)/c(Zn2+)=$\frac{c(C{u}^{2+})c(S{\;}^{2-})}{c(Z{n}^{2+})c({S}^{2-})}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$计算;
解答 解:(1)利用盖斯定律,将①×2+②×2+③可得反应2H2S(g)+4CH3OH(l)+O2(g)=2(CH3)2SO(l)+2H2O(g),所以生成l mol二甲基亚砜的△H=△H1+△H2+$\frac{1}{2}$△H3,根据题中的三个反应可知,二氧化氮氧化(CH3)2S,得到一氧化氮,一氧化氮又被氧化成二氧化氮,所以循环的物质是NO2,
故答案为:△H1+△H2+$\frac{1}{2}$△H3;NO2;
(2)H2S起始浓度为5mol•L-1,985℃时H2S的转化率为40%,则
2H2S(g)?2H2(g)+S2(g),
开始(mol•L-1) 5 0 0
转化(mol•L-1) 0.4×5 2 1
平衡(mol•L-1) 3 2 1
K=$\frac{1×{2}^{2}}{{3}^{2}}$=0.44;随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
当反应处于平衡状态时v正=v逆,根据v正=k正x2(H2S),v逆=k逆x2(H2)x(S2),可得k正x2(H2S)=k逆x2(H2)x(S2),所以k正=k•k逆,k逆=$\frac{k{\;}_{正}}{k}$,
故答案为:0.44;温度升高,反应速率加快,达到平衡所需时间缩短;$\frac{k{\;}_{正}}{k}$;
(3)根据装置图可知,①反应池中用铁离子将硫化氢氧化成硫,铁离子被还原成亚铁离子,反应的离子方程式为H2S+2Fe3+=2Fe2++S↓+2H+,
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+;
②反应后的溶液为氯化亚铁溶液,电解氯化亚铁时,阳极上亚铁离子被氧化成铁郭,阴极上水中的氢离子被还原成氢气,所以电解的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑,
故答案为:2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑;
(4)根据题意,c(Cu2+)/c(Zn2+)=$\frac{c(C{u}^{2+})c(S{\;}^{2-})}{c(Z{n}^{2+})c({S}^{2-})}$=$\frac{Ksp(CuS)}{Ksp(ZnS)}$=$\frac{1.3×10{\;}^{-36}}{2.0×10{\;}^{-22}}$=6.5×10-15,
故答案为:6.5×10-15.
点评 本题主要考查了盖斯定律的应用、平衡状态的判断、沉淀溶解的平衡计算以及电化学知识,难度中等,侧重于考查学生对基础知识的综合应用能力.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 中性食品 | B. | 碱性食品 | C. | 弱碱性食品 | D. | 酸性食品 |
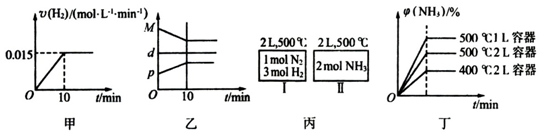
| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
| A. | 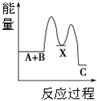 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 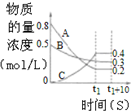 图表示反应的化学方程式为3A+B═2C | |
| C. | 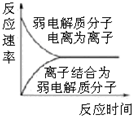 图表示弱电解质在水中建立电离平衡的过程 | |
| D. |  图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |