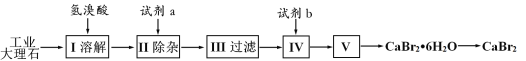
题目内容
【题目】已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示:
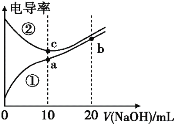
下列说法正确的是
A.曲线②代表滴定盐酸的曲线
B.滴定醋酸的过程应该选择甲基橙作为指示剂
C.a、b、c三点溶液中水的电离程度:a>c>b
D.b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+ c(CH3COOH)
【答案】AC
【解析】
A. 离子浓度越大溶液导电能力越强,其电导率越大,相同浓度的盐酸和醋酸,离子浓度:c(盐酸)>c(醋酸),所以电导率:盐酸>醋酸,根据图知,②代表滴定盐酸的曲线,故A正确;
B. 甲基橙变色范围为3.14.4,醋酸钠溶液呈碱性,所以应该选取酚酞作指示剂,故B错误;
C. a点溶质为醋酸钠、c点溶质为氯化钠、b点溶质为相同浓度的NaOH和醋酸钠,酸或碱抑制水电离,弱的离子促进水电离,a点促进水电离、b点抑制水电离、c点不影响水电离,则水电离程度:a>c>b,故C正确;
D. b点溶存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)、存在物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],所以存在c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D错误;
故选:AC。

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目