题目内容
某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
A(s)+2B(g)?D(g)+E(g)△H=Q kJ?mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
(1)T1℃时,该反应的平衡常数K= ;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是 (填字母编号).
a.通入一定量的B b.加入一定量的固体A
c.升高反应体系温度 d.同时加入0.2molB、0.1molD、0.1molE
(3)维持容器的体积和温度T1不变,当向该容器中加入1.60molB、0.20molD、0.20molE和n molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n应不少于 mol.
(4)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(5)若该密闭容器绝热,实验测得B的转化率B%随温度变化的示意图如图所示.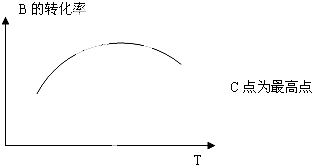
由图可知,Q 0 (填<、>、=),c点v(正) v(逆) (填<、>、=).
A(s)+2B(g)?D(g)+E(g)△H=Q kJ?mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是
a.通入一定量的B b.加入一定量的固体A
c.升高反应体系温度 d.同时加入0.2molB、0.1molD、0.1molE
(3)维持容器的体积和温度T1不变,当向该容器中加入1.60molB、0.20molD、0.20molE和n molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n应不少于
(4)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a=
(5)若该密闭容器绝热,实验测得B的转化率B%随温度变化的示意图如图所示.

由图可知,Q
考点:化学平衡常数的含义,化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)平衡时生成物的浓度幂之积之反应物浓度的幂之积;
(2)由图可知反应体系反应物和生成物的物质的量都增加;
(3)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol;
(4)温度不变平衡常数不变,来求a的值;
(5)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应.
(2)由图可知反应体系反应物和生成物的物质的量都增加;
(3)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol;
(4)温度不变平衡常数不变,来求a的值;
(5)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应.
解答:
解:(1)由表可知40分钟达平衡状态,所以K=
=0.25,故答案为:0.25;
(2)由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物,故选:ad;
(3)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol,
故答案为:0.3;
(4)A(s)+2B(g)?D(g)+E(g)
起始量 3.0mol amol 0mol
平衡量 3-0.5×2 a+0.50 0.50mol
=0.25,解得a=1.5,故答案为:1.5;
(5)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,故答案为:<;=.
| ||||
(
|
(2)由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物,故选:ad;
(3)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol,
故答案为:0.3;
(4)A(s)+2B(g)?D(g)+E(g)
起始量 3.0mol amol 0mol
平衡量 3-0.5×2 a+0.50 0.50mol
| ||||
(
|
(5)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,故答案为:<;=.
点评:本题是一题综合考查题,涉及化学平衡常数的计算、化学反应的转化、根据平衡常数求解以及图象问题,难度较大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列关于混合物分离的方法中,能够分离KNO3和NaCl的是( )
| A、溶解过滤 | B、结晶 |
| C、蒸馏 | D、萃取 |
下列实验操作中正确的是( )
| A、分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出 |
| B、用胶头滴管向试管滴加液体时,滴管尖端应紧靠试管内壁 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
 在密闭容器中进行反应CH4(g)+H20(g)?CO(g)+3H2(g)△H>0测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )
在密闭容器中进行反应CH4(g)+H20(g)?CO(g)+3H2(g)△H>0测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )| A、10 min时,改变的外界条件可能是温度 |
| B、0~5 min内,V(H2)=0.1 mol?L-1?min-1 |
| C、恒温下,缩小容器体积,平衡后c(H2)肯定减小 |
| D、10-12 min时反应的平衡常数逐渐增大 |
能源可划分为一次能源和二次能源,直接来自自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源.下列叙述正确的是( )
| A、水煤气是二次能源 |
| B、水力是二次能源 |
| C、天然气是二次能源 |
| D、电能是一次能源 |
某同学在实验报告中记录下列数据,其中正确的是( )
| A、用25mL量筒量取20.06mL盐酸 |
| B、用托盘天平称取5.25g食盐 |
| C、用100mL烧杯量取80.5mL盐酸 |
| D、用广泛pH试纸测得某盐酸溶液pH在3-4之间 |