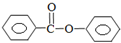题目内容
15.一种石墨烯锂硫电池(2Li+S8═Li2S8)工作原理示意如图.下列有关该电池说法正确的是( )
| A. | B电极发生还原反应 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1mol Li2S8转移0.25mol电子 | |
| D. | 电子从B电极经过外电路流向A电极,再经过电解质流回B电极 |
分析 在原电池中,电解质里的阳离子移向正极,所以A是正极,发生还原反应:2Li++S8+2e-═Li2S8,电子从原电池的负极流向正极,根据电极反应式结合电子转移进行计算即可.
解答 解:A、在原电池中,电解质里的阳离子移向正极,所以A是正极,发生还原反应,B是负极,发生氧化反应,故A错误;
B、A是正极,发生得电子的还原反应:2Li++S8+2e-═Li2S8,故B正确;
C、正极反应式:2Li++S8+2e-═Li2S8,每生成1molLi2S8转移2mol电子,故C错误;
D、电子从B电极经过外电路流向A电极,但是电子不会经过电解质溶液,故D错误.
故选B.
点评 本题考查化学电源新型电池,题目难度中等,注意把握原电池的工作原理和电极反应的判断.

练习册系列答案
相关题目
3.过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2+H2O2+2H+═Mn2++O2↑+2H2O
②Mn2++H2O2═MnO2+2H+
下列说法正确的是( )
①MnO2+H2O2+2H+═Mn2++O2↑+2H2O
②Mn2++H2O2═MnO2+2H+
下列说法正确的是( )
| A. | H2O2在①中是氧化剂,在②中是还原剂 | |
| B. | Mn2+在①中是还原产物,在②中是氧化产物 | |
| C. | 在①中每生成1 mol O2,转移的电子数为2.408×1024 | |
| D. | 在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2 |
10.Mg和SiO2在高温下反应生成MgO和Mg2Si.下列说法正确的是( )
| A. | 微粒的半径:Si>Mg | B. | 氧元素不存在同素异形体 | ||
| C. | Mg的还原性强于Si | D. | 该反应是置换反应,镁元素被氧化 |
4.下列说法错误的是( )
| A. | 从1L1mol/L的氯化钠溶液中取出10ml后,其浓度仍是1mol/L | |
| B. | NaHSO4溶液与NaOH溶液反应的离子方程式:H++OH-=H2O | |
| C. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| D. | 氧化剂具有氧化性,是得到电子(或电子对偏向)的物质,反应时本身被还原 |
5.如图实验装置或对实验现象的描述正确的是( )
| A. |  分馏装置 | B. |  配制150 mL 0.10 mol•L-1盐酸 | ||
| C. |  烧瓶内溶液变蓝色 | D. |  出现砖红色沉淀 |

 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
. 为原料,制备化合物
为原料,制备化合物 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.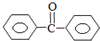 $→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$