题目内容
18.在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol.分析 N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,依据热化学方程式书写得到.
解答 解:N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,反应的热化学方程式为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
故答案为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol.
点评 本题考查了热化学方程式的书写方法和注意问题,掌握基础是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.某一元醇在红热的铜丝催化下,最多可被空气中的O2氧化成两种不同的产物(醛或酮).该一元醇的分子式可能是( )
| A. | C2H6O | B. | C3H8O | C. | C4H10O | D. | C5H12O |
6.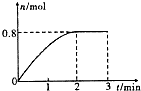 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
13.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气.已知:
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ•mol-1 | |
| C. | N2H4(g)+N2O4(g)═N2(g)+2H2O(g)△H=-1076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ•mol-1 |

 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: