题目内容
18.海洋深处有丰富的软锰矿(主要成分为MnO2,还含有少量铝、铜、镍等金属的化合物),软锰矿可作脱硫剂,工业上通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)
请回答下列问题:
(1)下列有关SO2的说法正确的是b(填正确答案的标号).
a.SO2有毒,食品中不能含有SO2
b.SO2能使酸性KMnO4溶液褪色
c.SO2是酸性氧化物,其水溶液是强酸
d.SO2通过CaCl2浓溶液能生成沉淀
(2)操作1的名称是过滤.
(3)用MnCO2能除去溶液中的Al3+,其原因是MnCO3消耗氢离子,促进Al3+水解生成氢氧化铝沉淀.
(4)加MnS除去Cu2+和Ni2+的原理是CuS和NiS的溶解度小于MnS的溶解度,发生沉淀的转化.
(5)MnO2是碱性锌锰电池的正极材料,写出该电池的总反应方程式Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2.
(6)根据图中信息,写出KMnO4与MnSO4溶液反应的离子反应方程式:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(7)假设脱硫过程中,SO2只与软锰矿浆中MnO2反应,其化学方程式为SO2+MnO2=MnSO4;将2240m3(标准状况)含有0.86%(体积分数)SO2的尾气通入矿浆,若SO2的脱除率为100%,则最终得到MnO2的质量为124.7kg(忽略除去铝、铜、镍等杂质时引入的锰).
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,MnS与铜、镍离子混合转化为CuS、NiS沉淀,过滤,滤液中含有硫酸锰,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰;
(1)a.食品在加工过程中,可能含有极少量的SO2;
b.SO2具有还原性,能与强氧化剂反应;
c.亚硫酸不是强酸;
d.SO2与CaCl2溶液不反应;
(2)操作1是分离固液混合物;
(3)MnCO3消耗氢离子,促进铝离子的水解;
(4)根据沉淀的转化分析;
(5)碱性锌锰电池中Zn与MnO2反应生成MnOOH和氢氧化锌;
(6)酸性条件下KMnO4与MnSO4溶液反应生成二氧化锰;
(7)SO2与软锰矿浆中的MnO2反应生成硫酸锰;根据方程式中二氧化硫与二氧化锰之间的关系计算.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+,MnS与铜、镍离子混合转化为CuS、NiS沉淀,过滤,滤液中含有硫酸锰,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰;
(1)a.食品在加工过程中,可能含有极少量的SO2,所以食品中允许含有极少量的SO2,故a错误;
b.SO2具有还原性,能与强氧化剂反应,所以SO2能使酸性KMnO4溶液褪色,故b正确;
c.SO2溶于水生成亚硫酸,亚硫酸不是强酸,故c错误;
d.SO2与CaCl2溶液不反应,所以SO2通过CaCl2浓溶液能生成沉淀,故d错误;
故答案为:b;
(2)操作1是分离固液混合物,所以其操作名称为过滤;故答案为:过滤;
(3)向溶液中加MnCO3会消耗氢离子,促进Al3+的水解生成氢氧化铝沉淀,从而除去溶液中的铝离子;
故答案为:MnCO3消耗氢离子,促进Al3+水解生成氢氧化铝沉淀;
(4)CuS和NiS的溶解度小于MnS的溶解度,当溶液中加MnS时会发生沉淀的转化,即生成CuS、NiS沉淀,从而除去铜离子和镍离子;
故答案为:CuS和NiS的溶解度小于MnS的溶解度,发生沉淀的转化;
(5)碱性锌锰电池中Zn与MnO2反应生成MnOOH和氢氧化锌,则碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
故答案为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
(6)酸性条件下KMnO4与MnSO4溶液反应生成二氧化锰,其反应的离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(7)SO2与软锰矿浆中的MnO2反应生成硫酸锰,其反应方程式为:SO2+MnO2=MnSO4;2240 m3(标准状况)含有0.86%(体积分数)SO2,二氧化硫的物质的量为$\frac{2240×1{0}^{3}L}{22.4L/mol}$×0.86%=860mol,
3SO2~3MnSO4~2MnO4-~5MnO2,
3 5
860mol n
则m(MnO2)=$\frac{860mol×5}{3}$×87g/mol=124700g=124.7kg;
故答案为:SO2+MnO2=MnSO4;124.7.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.

| A. | NaAt易溶于苯和四氯化碳等有机溶剂 | |
| B. | At的最高化合价为+7价 | |
| C. | At2是一种有色固体,与H2反应十分缓慢 | |
| D. | AgAt是有色固体,见光易分解 |
 得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )
得重感冒之后,常吃一种抗生素--头孢氨苄,分子式为C16H17N3O4S•H2O,其化学结构式如图,有关其说法正确的是( )| A. | 在一定条件下,能发生水解反应生成氨基酸 | |
| B. | 1mol该分子最多能与7molH2反应 | |
| C. | 该分子能与碳酸钠反应,不能与盐酸反应 | |
| D. | 头孢氨苄易溶于水,能使溴水褪色 |
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
 如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图.被膜隔开的电解质分别为Na2S2和 NaBr3,放电后变为Na2S4和NaBr.已知放电时Na+ 由乙池向甲池移动.下面对该装置工作过程中叙述正确的是( )| A. | 放电过程,甲池发生氧化反应 | |
| B. | 放电过程,电池反应:2S22-+Br3-=S42-+3Br- | |
| C. | 充电过程,乙池为阳极室 | |
| D. | 充电过程,当阳极室阴离子增加了2mol,整个电路中电子转移2mol |
| 侯氏制碱法 | 人工合成胰岛素 | 用青蒿素治疗疟疾 | 独创无氰电镀新工艺 |
 |  |  |  |
| A.以NH3、CO2、NaCl为原料最终制得纯碱 | B.由有机小分子合成有机高分子 | C.用萃取原理从青蒿素中提取青蒿素 | D.以铜盐、碱等溶液为电解质镀铜 |
| A. | A | B. | B | C. | C | D. | D |

 ;由B→C的反应类型是:取代反应.
;由B→C的反应类型是:取代反应. .
. .
. .
. ,请写出以
,请写出以 为原料制备化合物X
为原料制备化合物X  (结构简式见图)的合成路线流程图(无机试剂可任选):
(结构简式见图)的合成路线流程图(无机试剂可任选): .
.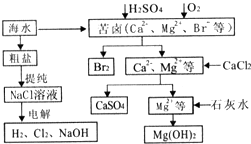 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.