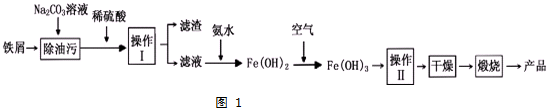
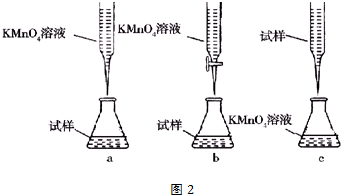
题目内容
15.短周期元素X、Y、Z中,X与Y的原子核外电子层数相同,X的原子半径大于Y,Xm+与Zn+具有相同的电子 层结构.下列叙述一定正确的是( )| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
分析 短周期主族元素X、Y、Z中,X与Y的原子核外电子层数相同,X的原子半径大于Y,则原子序数X<Y,二者不可能处于第一周期,可能处于第二或第三周期,Xm+与Zn+具有相同的电子层结构,则X、Z为金属元素,且二者同周期,Y可能为金属元素,也可能为非金属元素,据此解答.
解答 解:短周期主族元素X、Y、Z中,X与Y的原子核外电子层数相同,X的原子半径大于Y,则原子序数X<Y,二者不可能处于第一周期,可能处于第二或第三周期,Xm+与Zn+具有相同的电子层结构,则X、Z为金属元素,且二者同周期,Y可能为金属元素,也可能为非金属元素,
A.由上述分析可知,X、Y、Z处于同一周期,故A正确;
B.根据上述分析,原子序数X<Y,Xm+与Zn+具有相同的电子层结构,但m、n大小未知,故Z的原子序数不能确定,若Z扎起X前面,则序数小于X,在X后面,则大于X,也可介于XY之间,故X、Y、Z三种元素的原子半径依次减小不一定正确,故B错误;
C.根据上述分析,原子序数X<Y,Xm+与Zn+具有相同的电子层结构,但m、n大小未知,故Z的原子序数不能确定,若Z扎起X前面,则序数小于X,在X后面,则大于X,也可介于XY之间,故C错误;
D.Xm+与Zn+具有相同的电子层结构,若m>n,则核电荷数X>Z,核电荷数越大,离子半径越小,则Xm+的半径小于Zn+的径,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,注意确定元素在周期表中位置,注意Y元素的不确定性,难度中等.

练习册系列答案
相关题目
8.已知W、X、Y、Z、R是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,且原子序数相差8,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中正确的是( )
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
6.下列关于化学平衡的说法中,正确的是( )
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
10.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2).用浓盐酸溶解钛铁矿去渣得溶液(含有Fe2+、TiOCl42-等),调节溶液的pH并加热,过滤的TiO2和滤液.控制反应温度在95℃左右,向滤液中加入H2O2和NH4H2PO4得到FePO4.再将FePO4与Li2CO3和H2C2O4一起煅烧,可制取LiFePO4.有关数据如下表所示:
(1)FeTiO3中Ti的化合价为+4,盐酸与FeTiO3反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.检验溶液中Fe2+的方法是先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色.
(2)为提供FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5 c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2.则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨作阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提供FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5 c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2.则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨作阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
20.“电池新贵”铝电池是用石墨作为正极材料,用有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作为电解液的二次电池,电池充电快、容量高、成本低、也很安全.已知该电池工作的过程中不产生其他离子且有机阳离子不参与电极反应,则下列说法正确的是( )
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
7.向0.1mol/L的NH4HCO3溶液中逐滴加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数).根据图象,下列说法不正确的是( )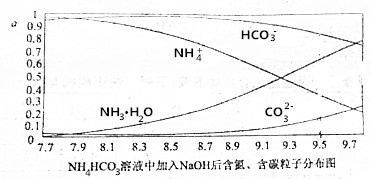

| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
4.下列有关说法不正确的是( )
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
5.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程.

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑
、.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式)冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑
、.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式)冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.