题目内容
11.六水合硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下: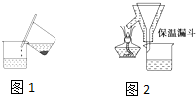
步骤1:铁屑的处理.将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥.
步骤2:FeSO4溶液的制备.向锥形瓶中加入30mL的3mol•L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止.趁热过滤(如图2所示),收集滤液和洗涤液.
步骤3:六水合硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体.
请回答下列问题:
(1)趁热过滤的目的和理由是过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失.
(2)①步骤3中的一系列操作包括:蒸发浓缩、冷却结晶、过滤.
②洗涤硫酸亚铁铵晶体最好用什么试剂:乙醇.
分析 步骤1:铁屑的处理,碳酸钠溶液呈碱性,将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,可除去表面的油脂,用倾析方法分离出固体并洗涤、干燥;
步骤2:FeSO4溶液的制备.向锥形瓶中加入30mL的3mol•L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止.趁热过滤,可防止趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失,收集滤液和洗涤液;
步骤3:六水合硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过蒸发浓缩、冷却结晶、过滤、洗涤后得到六水合硫酸亚铁铵晶体,因不溶于酒精,可用酒精洗涤,以此解答该题.
解答 解:(1)温度较高时硫酸亚铁的溶解度较大,溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
故答案为:过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失;
(2)①加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,故答案为:蒸发浓缩、冷却结晶、过滤;
②通过减压过滤(或抽滤)等得到较为干燥的晶体,硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水,故答案为:乙醇.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验步骤的分析判断,物质制备的实验设计方法,性质验证,晶体析出方法的应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列有关描述或应用中,不正确的是( )
| A. | 1molNH4+的质量为18g | |
| B. | SO2的摩尔质量为64g•mol-1 | |
| C. | 铝原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个水分子的质量约等于$\frac{18}{6.02×1{0}^{23}}$g |
16.下列有关物质的性质说法正确的是( )
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
13.血液的常规检测中,测得某同学葡萄糖的浓度是2.52mmol•L-1,总胆红素的浓度是9.2μmol•L-1.葡萄糖浓度的正常范围是3.61~6.11mmol•L-1,总胆红素浓度的正常范围是0~19μmol•L-1.下列说法正确的是( )
| A. | 该同学的葡萄糖的浓度偏高 | |
| B. | 该同学的葡萄糖的浓度比总胆红素的浓度高 | |
| C. | 该同学的总胆红素的浓度比葡萄糖的浓度高 | |
| D. | 该同学的总胆红素的浓度出现异常 |
6.“粗盐提纯”的实验中,蒸发时,正确的操作是( )
| A. | 把浑浊的液体倒入蒸发皿中加热 | B. | 开始析出晶体后用玻璃棒搅拌 | ||
| C. | 待水分完全蒸干后停止加热 | D. | 蒸发皿中出现多量固体时停止加热 |
16. 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
(4)欲提高SO2的反应速率和转化率,下列措施可行的是B(填选项字母).
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
3.表中能量表示将1mol分子完全拆解成原子所消耗的能量,
已知A2(g)与氢气化合生成1molHA(g)时放出的热量为92.5kJ,结合以上信息,下列说法正确的是( )
| 物质 | H2(g) | A2(g) | B2(g) | HA(g) | HB(g) |
| 能量(kJ) | 436 | a | 193 | 432 | 366 |
| A. | 能量最高的分子是H2 | B. | 最稳定的分子是B2 | ||
| C. | a=243 | D. | HB(g)+A2(g)═B2(g)+HA(g) 是吸热反应 |
20.化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A. | 朝鲜第三次核试验产生的放射性物质的衰变为化学变化 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨 | |
| C. | 为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 | |
| D. | 用高纯度二氧化硅制作的光导纤维遇强碱会“断路” |