题目内容
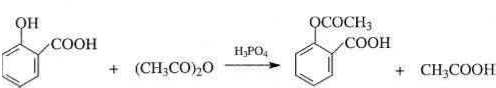
13.由乙酰水杨酸(ASS)制成的阿司匹林是德国一家制药公司于1899年合成出的止痛剂(Pain Relieferes).长时间以来一直被广泛的使用,现在每年的需求量仍是很高.ASS可由下列反应序列合成制得: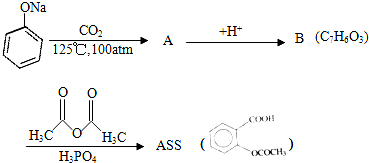
(1)写出A与B的结构简式及B与乙酸酐反应的化学方程式
 ;
; ;
; .
.(2)B物质与乙酸酐反应时,还会生成一些副产品,其中有一种是高分子,其结构简式为
 .为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.
.为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.(3)为了测定自制乙酸水杨酸的纯度,一般可采用以下步骤:准确称取自制的乙酰水杨酸三份,每份约0.25g,分别置于250ml锥形瓶中,加入25ml 95%乙醇(已调至对酚酞指示剂显中性),摇动使其溶解,再向其中加入适量酚酞指示剂,用准确浓度的NaOH溶液滴定至出现微红色,30秒钟不变色为终点,分别记录所消耗NaOH溶液的体积,根据所消耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.滴定需在不断振荡下且较快地进行,防止因NaOH局部过浓和滴定时间过长而使产品水解.
(4)为了测定阿司匹林片剂中乙酰水杨酸的含量,通常采用返滴定法.步骤为:称取10片药物(设总质量为W总/g),研细混匀后,准确称取一定量(G/g)药粉于锥形瓶中,加入V1/mL(过量)的NaOH标准溶液[浓度c(NaOH)/moL•L-1],于水浴上加热使乙酰基水解完全后,再用HCL标准溶液[浓度c(HCL)/moL•L-1]回滴,以酚酞为指示剂,耗去HCL溶液V2/mL.请列出求算每片药中含有乙酰水杨酸的质量(g/片)的计算式.含量(g/片)=$\frac{\frac{1}{2}×[c(NaOH)V{\;}_{1}-c(HCl)V{\;}_{2}]}{1000G}$×$\frac{W{\;}_{总}}{10}$.
已知乙酰水杨酸可溶于NaOH溶液中,并生成水杨酸盐和乙酸盐.其溶解反应式可表示为:
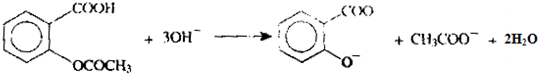
乙酰水杨酸的摩尔质量为180.2g.moL-1,(滴定终点产物为:
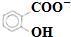 和CH3COO-)
和CH3COO-)
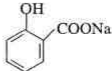
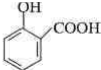
分析 乙酰水杨酸结构为: ,乙酰水杨酸是由B和乙酸酐反应制得,则B为:
,乙酰水杨酸是由B和乙酸酐反应制得,则B为: ,B由A酸化得到,则A为:
,B由A酸化得到,则A为: ,水杨酸含羟基和羧基,在一定条件下能发生缩聚反应;由于水杨酸的pKal=3.0,pKa2=13.1,乙酸的pKa=4.75,而酚酞终点pH=9.0,可见终点时产物为:
,水杨酸含羟基和羧基,在一定条件下能发生缩聚反应;由于水杨酸的pKal=3.0,pKa2=13.1,乙酸的pKa=4.75,而酚酞终点pH=9.0,可见终点时产物为: ,因此在测定中,每一摩尔的乙酰水杨酸消耗2mol的NaOH,据此计算.
,因此在测定中,每一摩尔的乙酰水杨酸消耗2mol的NaOH,据此计算.
解答 解:(1)乙酰水杨酸结构为: ,乙酰水杨酸是由B和乙酸酐反应制得,则B为:
,乙酰水杨酸是由B和乙酸酐反应制得,则B为: ,B由A酸化得到,则A为:
,B由A酸化得到,则A为: ,B与乙酸酐反应的方程式为:
,B与乙酸酐反应的方程式为: ,
,
故答案为: ,
, ,
, ;
;
(2)水杨酸能发生缩聚反应,反应温度过高,生成的高分子化合物可能为 ,乙酰水杨酸能溶于碳酸氢钠溶于,而此高分子不溶,故在产物中加入饱和碳酸氢钠溶液,过滤除去不溶物,再酸化得到乙酰水杨酸,故答案为:
,乙酰水杨酸能溶于碳酸氢钠溶于,而此高分子不溶,故在产物中加入饱和碳酸氢钠溶液,过滤除去不溶物,再酸化得到乙酰水杨酸,故答案为: ;饱和碳酸氢钠溶液;
;饱和碳酸氢钠溶液;
(3)乙酰水杨酸含酯基,酯在碱性条件下,故滴定需在不断振荡下且较快地进行,防止因NaOH局部过浓和滴定时间过长而使产品水解,
故答案为:滴定需在不断振荡下且较快地进行,防止因NaOH局部过浓和滴定时间过长而使产品水解;
(4)由于水杨酸的pKal=3.0,pKa2=13.1,乙酸的pKa=4.75,而酚酞终点pH=9.0,可见终点时产物为: ,因此在测定中,每一摩尔的乙酰水杨酸消耗2mol的NaOH.含量(g/片)=$\frac{\frac{1}{2}×[c(NaOH)V{\;}_{1}-c(HCl)V{\;}_{2}]}{1000G}$×$\frac{W{\;}_{总}}{10}$,
,因此在测定中,每一摩尔的乙酰水杨酸消耗2mol的NaOH.含量(g/片)=$\frac{\frac{1}{2}×[c(NaOH)V{\;}_{1}-c(HCl)V{\;}_{2}]}{1000G}$×$\frac{W{\;}_{总}}{10}$,
故答案为:$\frac{\frac{1}{2}×[c(NaOH)V{\;}_{1}-c(HCl)V{\;}_{2}]}{1000G}$×$\frac{W{\;}_{总}}{10}$.
点评 本题考查有机物的推断,题目难度较大,本题的推断采用逆推法解答,突破口为乙酰水杨酸的结构,易错点为(4),注意把握.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 氯水中加入石蕊试液,溶液只变红 | |
| B. | 配制一定物质的量浓度的溶液定容时仰视刻度会使得溶液浓度偏小 | |
| C. | 过氧化钠和HClO都可以使有色物质褪色且原理相同 | |
| D. | 向某溶液中滴加AgNO3溶液后,再加稀HNO3酸化,有黄色沉淀产生,证明含I- |
| A. | 向硫代硫酸钠溶液中滴加稀硫酸会产生淡黄色沉淀和刺激性气味气体 | |
| B. | 向5mL 0.1mol/L的K2Cr2O7溶液中滴加10滴6mol/L的NaOH溶液后溶液的橙色加深 | |
| C. | 测定中和热时,若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两次实验测定的中和热是相等的 | |
| D. | KMnO4溶液与草酸溶液反应时褪色速度先慢后快 |
| A. | 强碱性溶液中:Na+、K+、SO42-、CO32- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、CO32- | |
| C. | 无色透明溶液中:HCO3-、Na+、Cl-、OH- | |
| D. | 使石蕊变红的溶液中:Na+、Ca2+、HCO3-、SO42- |
 反应能得到化学式为C7H4O3Na2的是( )
反应能得到化学式为C7H4O3Na2的是( )| A. | NaHCO3溶液 | B. | Na2CO3溶液 | C. | NaOH溶液 | D. | NaCl溶液 |

| A. | 强光照射能较快看到白雾 | |
| B. | 若试管套上黑色纸套,试管内气体颜色逐渐变浅 | |
| C. | 水槽底部可能有少量晶体 | |
| D. | 充分反应后试管中仍有气体 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).(2)②、③、⑤、⑥、⑦形成的气态氢化物中最稳定的是HF(填化学式).
(3)④与②组成的某种化合物和①与②组成的某种化合物反应生成氧气,写出这两种化合物的电子式
 ,
, .
.(4)用电子式表示元素④与⑥构成化合物的形成过程:
 .
.  和
和 ⑦
⑦ 和
和