题目内容
1.下列有关实验的叙述不正确的是( )| A. | 向硫代硫酸钠溶液中滴加稀硫酸会产生淡黄色沉淀和刺激性气味气体 | |
| B. | 向5mL 0.1mol/L的K2Cr2O7溶液中滴加10滴6mol/L的NaOH溶液后溶液的橙色加深 | |
| C. | 测定中和热时,若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两次实验测定的中和热是相等的 | |
| D. | KMnO4溶液与草酸溶液反应时褪色速度先慢后快 |
分析 A、硫代硫酸钠和稀硫酸反应生成硫单质和二氧化碳气体;
B.重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,据此分析;
C.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;
D.反应中生成的MnSO4(Mn2+)对该反应有催化作用.
解答 解:A、硫代硫酸钠和稀硫酸反应生成硫单质和二氧化碳气体,S2O32-+2H+=S↓+SO2↑+H2O,会产生淡黄色沉淀和刺激性气味气体二氧化硫,故A正确;
B.重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,加10滴6mol/L的NaOH溶液后溶液平衡逆向进行,溶液的橙色变浅,故B错误;
C.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以两反应测定的中和热相等,故C正确;
D.反应过程中溶液中锰离子浓度逐渐增大,锰离子浓度对反应速率有影响,所以草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色先慢后快的主要原因是:反应生成的MnSO4(Mn2+)对该反应有催化作用,故D正确;
故选B.
点评 本题考查了实验探究方法、探究影响化学反应速率和化学平衡的因素,题目难度中等,明确催化剂、浓度等因素对化学反应速率的影响为解答关键,试题培养了学生的分析、归纳能力及化学实验能力.

练习册系列答案
相关题目
9.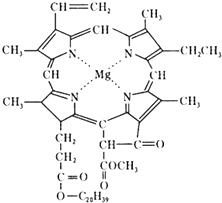 我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如图所示,下列有关说法正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如图所示,下列有关说法正确的是( )
 我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如图所示,下列有关说法正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如图所示,下列有关说法正确的是( )| A. | 叶绿素属于高分子化合物 | |
| B. | 叶绿素分子中含有两种类型的双键 | |
| C. | 叶绿素不属于芳香烃 | |
| D. | 在一定条件下,叶绿素能加成、水解、酯化等反应 |
16.石油裂化的目的是( )
| A. | 除去石油中的杂质 | B. | 提高石油的年产量 | ||
| C. | 使直连烃转化为芳香烃 | D. | 提高汽油的产量和质量 |
6.能说明苯分子中碳碳键不是单、双键交替的事实是( )
①苯不能使KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③邻二氯苯只有一种;
④在一定条件下苯与H2发生加成反应生成环己烷.
①苯不能使KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③邻二氯苯只有一种;
④在一定条件下苯与H2发生加成反应生成环己烷.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ①②④ |
10.下列说法正确的是( )
| A. | 石油分馏的馏分之一是石油气,石油气含有大量的己烷 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| D. | 使用煤液化的产品作燃料与直接燃烧煤比较,对保护环境有利,目前,煤液化的唯一途径是将煤在高温和催化剂条件下与氢气反应 |
11.将一根橡皮筋拉伸,松开手,橡皮筋恢复原状.橡皮筋能够恢复原状主要是因为( )
| A. | 此过程是一个放热的过程 | B. | 此过程是一个熵增加的过程 | ||
| C. | 此过程是一个熵减少的过程 | D. | 此过程是一个自由能增加的过程. |

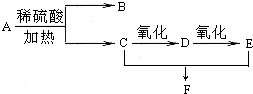 化合物A的分子式为C3H6O2,它有如图所示转化关系,已知D、E、F在加热条件下都能与碱性新制Cu(OH)2悬浊液生成砖红色沉淀:
化合物A的分子式为C3H6O2,它有如图所示转化关系,已知D、E、F在加热条件下都能与碱性新制Cu(OH)2悬浊液生成砖红色沉淀: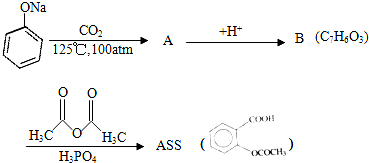
 ;
; ;
;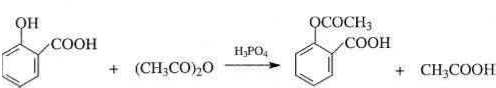 .
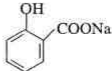
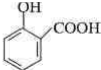
. .为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.
.为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.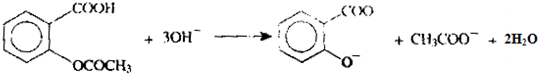
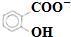 和CH3COO-)
和CH3COO-)