题目内容
8.在下列各组溶液中,一定能大量共存的离子组是( )| A. | 强碱性溶液中:Na+、K+、SO42-、CO32- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、CO32- | |
| C. | 无色透明溶液中:HCO3-、Na+、Cl-、OH- | |
| D. | 使石蕊变红的溶液中:Na+、Ca2+、HCO3-、SO42- |
分析 A.强碱性溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.铁离子、镁离子都与碳酸根离子反应;
C.碳酸氢根离子与氢氧根离子反应;
D.使石蕊变红的溶液中存在大量氢离子,碳酸氢根离子与氢离子反应,钙离子与硫酸根离子生成微溶物硫酸钙.
解答 解:A.Na+、K+、SO42-、CO32-之间不发生反应,都不与强碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Fe3+、Mg2+都与CO32-发生反应,在溶液中不能大量共存,故B错误;
C.HCO3-、OH-之间发生反应生成碳酸根离子和水,在溶液中不能大量共存,故C错误;
D.使石蕊变红的溶液呈酸性,溶液中存在大量氢离子,HCO3-与氢离子反应,Ca2+、SO42-之间反应生成微溶物硫酸钙,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
18.2005年1月14日“惠更斯”号探测器成功登陆了土卫六,根据发回的照片和数据分析,土卫六“酷似地球经常下雨”,不过“雨”的成份是以液态甲烷为主的一些碳氢化合物.下列说法中,错误的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 甲烷是一种比较洁净的能源 | ||
| C. | 石油的主要成分是碳氢化合物 | D. | 甲烷的二氯代物无同分异构体 |
19.我国古代的科学技术高度发达,在许多成语中都蕴含了化学原理,如表有关解释不正确的是( )
| 成语 | 化学原理 | |
| A | 火树银花 | 发生了焰色反应 |
| B | 炉火纯青 | 通过观察火焰的颜色来判断炉内的温度 |
| C | 百炼成钢 | 通过多次锻炼,使生铁中碳等杂质因挥发而降低达到了钢的标准 |
| D | 青出于蓝而胜于蓝 | 蓝色的靛蓝染料发生化学反应生成一种深蓝色的新染料 |
| A. | A | B. | B | C. | C | D. | D |
16.石油裂化的目的是( )
| A. | 除去石油中的杂质 | B. | 提高石油的年产量 | ||
| C. | 使直连烃转化为芳香烃 | D. | 提高汽油的产量和质量 |
3.下列关于甲烷分子结构的说法正确的是( )
| A. | 甲烷的电子式为: ,分子中各原子都达到“八电子”稳定结构 ,分子中各原子都达到“八电子”稳定结构 | |
| B. | CHCl3只有一种结构,说明甲烷是以碳原子为中心的正四面体结构 | |
| C. | CH4比SiH4分子稳定,说明碳元素比硅元素非金属性强 | |
| D. | CH3Cl的四个价键的长度和强度相同,夹角相等 |
17.下列物质属于烃的是( )
| A. | CH3CCl | B. | CH3CH3 | C. | 溴苯 | D. | 硝基苯 |
4.一丝不苟,养成良好的实验操作习惯,是确保安全与实验成功的重要前提.下列四项基本实验操作中,正确的是( )
| A. |  闻气味 | B. |  倾倒液体 | C. |  取固体药品 | D. |  稀释浓硫酸 |
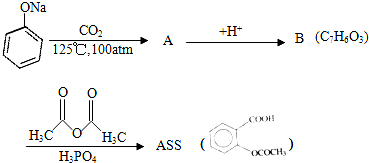
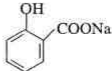 ;
;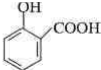 ;
;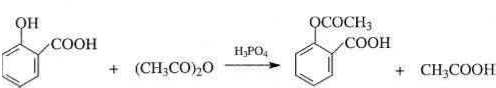 .
. .为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.
.为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.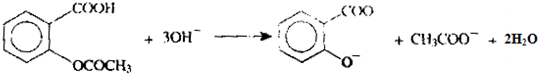
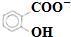 和CH3COO-)
和CH3COO-)
 ,
, 或
或 ;
; 、
、 、
、 、
、 ;
; ,D→E
,D→E .
.