题目内容
沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×l0-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中 (填“还含有”或“不含有”)Al (OH)3(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×l0-33).
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:当Fe3+完全沉淀时,求出溶液中c(OH-),再求出c(Al3+)×c3(OH-)与进行比较,判断是否有Al(OH)3沉淀生成.
解答:
解:当Fe3+完全沉淀时,c(Fe3+)=1.0×10-5,c(OH-)=
,
此时Al3+和OH-的浓度商c(Al3+)×c3(OH-)=0.2mol/L×(
)3=0.7×10-33mol/L<1.1×10-33;
所以没有Al(OH)3沉淀.
故答案为:不含有.
| 3 |
| ||
此时Al3+和OH-的浓度商c(Al3+)×c3(OH-)=0.2mol/L×(
| 3 |
| ||
所以没有Al(OH)3沉淀.
故答案为:不含有.
点评:本题考查溶度积的应用,综合性强,为高考常见题型.

练习册系列答案
相关题目
下列物质中属于有机高分子化合物的是( )
| A、乙醇 | B、蛋白质 |
| C、阿斯匹林 | D、蔗糖 |
下列气体不能用来做喷泉实验的是( )
| A、NH3 |
| B、HCl |
| C、SO2 |
| D、NO |
N2O5是一种新型硝化剂,一定温度下,在恒压密闭容器中充入4mol NO2、1mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g)达到平衡时,N2O5的浓度为a mol?L-1;若保持其他条件不变,起始时向容器中充入8mol NO2、2mol O2,达到平衡时,N2O5的浓度为( )
A、
| ||
| B、a mol?L-1 | ||
| C、2a mol?L-1 | ||
| D、无法确定 |
在一定温度下的恒容容器中,当下列物理量不变时,不能表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡的是( )
| A、混合气体压强 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、B的物质的量浓度 |
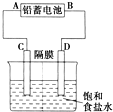 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4