题目内容
18.设阿伏加德罗常数为NA,则下列说法正确的是( )| A. | 78 g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 常温常压下,28 g CO和N2的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,22.4 L H2S和SO2的混合气体中含有的分子总数为NA |
分析 A、质量换算物质的量结合过氧化钠构成离子分析判断;
B.碳酸钠溶液中碳酸根离子部分水解生成氢氧根离子,钠离子的物质的量大于碳酸根离子的2倍;
C.一氧化碳和氮气的摩尔质量都是28g/mol,28g混合物的物质的量为1mol;
D.二氧化硫与硫化氢能够反应生成硫单质和水,二者混合后气体的总物质的量减小.
解答 解:A、78g过氧化钠晶体物质的量为1mol,含阴离子O22-物质的量1mol,含NA个阴离子,故A错误;
B.25℃时,1L pH=12的Na2CO3溶液中含有0.01mol氢氧根离子,碳酸根离子在溶液中部分水解生成氢氧根离子,所以碳酸根离子的物质的量大于0.01mol,钠离子的物质的量大于0.02mol,溶液中含有Na+的数目大于0.02NA,故B错误;
C.28g氮气和一氧化碳的物质的量为1mol,1mol混合物中含有1mol气体分子,含有的分子总数为NA,故C正确;
D.标准状况下,22.4L 气体的物质的量为1mol,由于硫化氢氢与氧气反应生成硫电子和水,气体的物质的量减小,混合后气体的分子数小于NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下的气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
9.设NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24LSO3所含分子数为0.1NA | |
| B. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| C. | 1molNa2O2与足量水反应转移的电子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
6.中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,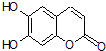 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
13.如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )


| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
3.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第VIIA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为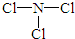 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为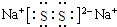 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
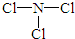 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
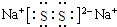 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
10.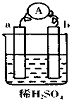 在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
 在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )
在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是( )| A. | 碳棒上有气体放出,溶液pH变小 | B. | a是正极,b是负极 | ||
| C. | 溶液中阳离子移向a极 | D. | a极上发生了氧化反应 |
 某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求
某有机物X相对氢气的密度为30,9g该有机物在空气中充分燃烧,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重13.2g.通过计算,求
 ,B含有的含氧官能团是酯基(写名称).
,B含有的含氧官能团是酯基(写名称). ,D为CH3CH2CH2CHO.
,D为CH3CH2CH2CHO. .
.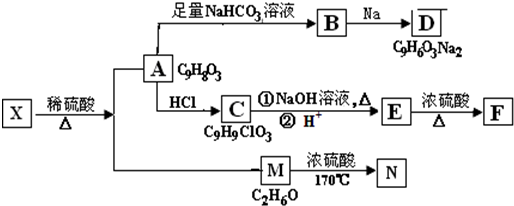
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.