题目内容
已知反应:Cl-+ClO-+2H+=Cl2↑+H2O,下列说法正确的是( )
| A、符合该离子方程式的化学方程式可以是:HClO+HCl=Cl2↑+H2O |
| B、在无色碱性溶液中:ClO、Cl-、Al3+、Na+能大量共存 |
| C、标准状况下,每生成1.12LCl2,转移0.05NA电子 |
| D、洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应ClO-+Cl-+2H+=Cl2↑+H2O中,只有Cl元素化合价发生变化,分别由+1价、-1价变化为0价,ClO-具有强氧化性,以此解答该题.
解答:
解:A.HClO为弱酸,应写成化学式,故A错误;
B.碱性条件下,Al3+不能大量共存,故B错误;
C.标准状况下,每生成1.12L Cl2,即0.05mol,由方程式可知,转移电子为0.05mol×(1-0)=0.05mol,故C正确;
D.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用,发生氧化还原反应生成氯气,可导致失效,且易中毒,故D错误.
故选C.
B.碱性条件下,Al3+不能大量共存,故B错误;
C.标准状况下,每生成1.12L Cl2,即0.05mol,由方程式可知,转移电子为0.05mol×(1-0)=0.05mol,故C正确;
D.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用,发生氧化还原反应生成氯气,可导致失效,且易中毒,故D错误.
故选C.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和判断的考查,注意利用实例分析,题目难度不大.

练习册系列答案
相关题目
新型净水机高铁酸钾(K2FeO4)为暗紫色固体,可溶于水工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH.下列说法不正确的是( )
| A、Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| B、反应①中,NaClO是氧化剂 |
| C、反应①为氧化还原反应,反应②为复分解反应 |
| D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
化学与生活、环境密切相关,下列说法错误的是( )
| A、生活中钢铁制品生锈主要是由于吸氧腐蚀所致 |
| B、石油的裂化、裂解和煤的干馏都属于化学变化 |
| C、天然纤维、人造纤维、合成纤维组成元素相同 |
| D、工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去 |
下列递变情况中,正确的是( )
| A、Na、Mg、Al原子的最外层电子数依次减少 |
| B、C、N、O的原子半径依次减小 |
| C、Si、P、S元素的最高正化合价依次降低 |
| D、Li、Na、K的金属性依次减弱 |
下列说法正确的是( )
| A、C5H12有四种同分异构体; |
| B、C2H6与C5H10一定是同系物; |
| C、标准状况下,1mol的己烷约为22.4L |
| D、CH3CH(CH3)CH2CH2C(CH3)3的名称;为2,2,5-三甲基己烷. |

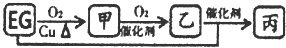 (无机反应物、生成物均已略去):
(无机反应物、生成物均已略去):