题目内容
氮氧化物是造成空气污染和雾霾天气的原因之一.
(1)可用NH3还原氮氧化物:NH3+NO+NO2→N2+H2O(未配平),已知1mol NO2和一定量的NO共消耗4molNH3,则反应中转移的电子总数为 ,参加反应的NO的物质的量为 .
(2)可用甲烷催化还原氮氧化物.
CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g) K1△H1
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g) K2△H2
则CH4(g)+2NO2(g)?N2(g)+CO2(g)+22O(g)△H= (用△H1、△H2表示),该反应的化学平衡常数K= (用K1、K2表示)
(3)将CO和NO2通过燃料电池转化为CO2和N2,可实现除污和发电,该电池以Na2O为电解质,在熔融状态下传导O2-,其正极电极反应式为 .
(4)如图所示,用电解方法消除酸性废水中的NO3-,电源正极为 (填“a”或“b”),阴极反应式为 .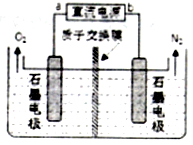
(1)可用NH3还原氮氧化物:NH3+NO+NO2→N2+H2O(未配平),已知1mol NO2和一定量的NO共消耗4molNH3,则反应中转移的电子总数为
(2)可用甲烷催化还原氮氧化物.
CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g) K1△H1
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g) K2△H2
则CH4(g)+2NO2(g)?N2(g)+CO2(g)+22O(g)△H=
(3)将CO和NO2通过燃料电池转化为CO2和N2,可实现除污和发电,该电池以Na2O为电解质,在熔融状态下传导O2-,其正极电极反应式为
(4)如图所示,用电解方法消除酸性废水中的NO3-,电源正极为

考点:原电池和电解池的工作原理,氧化还原反应的计算,化学平衡常数的含义
专题:
分析:(1)NH3中的氮由-3价变为0价,1mol的氮转移3mol的电子;根据得失电子守恒分析解答;
(2)根据盖斯定律分析解答;根据平衡常数表达式书写;
(3)正极发生还原反应,元素化合价降低,由此分析;
(4)根据图象知,硝酸根离子得电子发生氧化反应,生成氮气,所a为正极,以此解答该题.
(2)根据盖斯定律分析解答;根据平衡常数表达式书写;
(3)正极发生还原反应,元素化合价降低,由此分析;
(4)根据图象知,硝酸根离子得电子发生氧化反应,生成氮气,所a为正极,以此解答该题.
解答:
解:(1)NH3中的氮由-3价变为0价,1mol的氮转移3mol的电子,所以消耗4molNH3,转移电子数为12NA;根据得失电子守恒,1mol NO2的得到4mol的电子,还需4mol的NO得到8mol的电子,故答案为:12NA;4mol;
(2)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)①;CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)②,目标反应为:
,所以△H=
,K=
,故答案为:
;
;
(3)正极发生还原反应,氮元素化合价降低,所以电极反应式为:2NO2+8e-=N2+4O2-,故答案为:2NO2+8e-=N2+4O2-;
(4)根据图象知,硝酸根离子得电子发生氧化反应,生成氮气,所以a为正极,阴极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:a;2NO3-+12H++10e-=N2↑+6H2O.
(2)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)①;CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)②,目标反应为:
| ①+② |
| 2 |
| △H1+△H2 |
| 2 |
| K1×K2 |
| △H1+△H2 |
| 2 |
| K1×K2 |
(3)正极发生还原反应,氮元素化合价降低,所以电极反应式为:2NO2+8e-=N2+4O2-,故答案为:2NO2+8e-=N2+4O2-;
(4)根据图象知,硝酸根离子得电子发生氧化反应,生成氮气,所以a为正极,阴极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:a;2NO3-+12H++10e-=N2↑+6H2O.
点评:本题考查了电解原理,明确阴阳极上发生的电极反应及离子移动方向、阴阳极的判断方法等知识点即可解答,难点是电极反应式的书写,难度中等.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
已知反应:Cl-+ClO-+2H+=Cl2↑+H2O,下列说法正确的是( )
| A、符合该离子方程式的化学方程式可以是:HClO+HCl=Cl2↑+H2O |
| B、在无色碱性溶液中:ClO、Cl-、Al3+、Na+能大量共存 |
| C、标准状况下,每生成1.12LCl2,转移0.05NA电子 |
| D、洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好 |
下列事实不能用电化原理解释的是( )
| A、镀锌铁片比镀锡铁片更耐腐蚀 |
| B、远洋海伦的尾巴都装上一定数量的锌板 |
| C、常温条件下,在空气中铝不易被腐蚀 |
| D、用锌与稀硫酸制取氧气时,往硫酸溶液中加少量硫酸铜 |
下列说法正确的是( )
| A、CH3-CH=CH2分子中所有原子一定处于同一平面 |
| B、除去乙烷中的乙烯是将混气通入酸性KMnO4溶液中 |
| C、若烃中碳、氢元素的质量分数相同,它们可能是同系物 |
| D、某烷烃的命名为3,4,4一三甲基己烷 |
下列说法正确的是( )
| A、所有的放热效应都能在常温常压下自发进行 |
| B、明矾加热变为白色粉末放热反应 |
| C、天然气燃烧时,其化学能全部转化为热能 |
| D、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
下列化学反应中,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键形成的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ |
| B、Mg3N2+6H2O═3Mg(OH)2+2NH3↑ |
| C、Cl2+H2O═HCl+HClO |
| D、NH4Cl+NaOH═NaCl+NH3↑+H2O |

