题目内容
现有四种元素.其中两种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;另两种元素的特征电子构型为③2s22p3;④2s22p5.则下列有关比较中正确的是( )
| A、第一电离能:④>③>①>② |
| B、原子半径:②>①>③>④ |
| C、电负性:③>④>①>② |
| D、最高正化合价:④>①>③=② |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、③2s22p3是N元素、④2s22p5是F元素,
A.同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,注意全满、半满稳定状态;
B.根据同周期自左而右原子半径减小、电子层越多原子半径越大分析判断;
C.同周期自左而右电负性增大,非金属性越强电负性越大;
D.最高正化合价等于最外层电子数,但F元素没有正化合价.
A.同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,注意全满、半满稳定状态;
B.根据同周期自左而右原子半径减小、电子层越多原子半径越大分析判断;
C.同周期自左而右电负性增大,非金属性越强电负性越大;
D.最高正化合价等于最外层电子数,但F元素没有正化合价.
解答:
解:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、③2s22p3是N元素、④2s22p5是F元素,
A.同周期自左而右第一电离能呈增大趋势,故第一电离能N<F,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,所以第一电离能S<P<N<F,即④>③>②>①,故A错误;
B.同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,故B正确;
C.同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性与S元素强,所以电负性P<N,故电负性P<S<N<F,即②<①<③<④,故C错误;
D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③,故D错误.
故选B.
A.同周期自左而右第一电离能呈增大趋势,故第一电离能N<F,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,所以第一电离能S<P<N<F,即④>③>②>①,故A错误;
B.同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,故B正确;
C.同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性与S元素强,所以电负性P<N,故电负性P<S<N<F,即②<①<③<④,故C错误;
D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③,故D错误.
故选B.
点评:考查结构与物质关系、核外电子排布规律、元素周期律等,为高频考点,侧重于学生的分析能力的考查,为高频考点,难度不大,根据原子结构褪色元素是关键,注意基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质只表示一种纯净物的是( )
| A、C2H6 |
| B、C5H12 |
| C、C2H4Cl2 |
| D、C2H6O |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA |
| C、标准状况下,1NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol?/L的MgCl2溶液中,含有Cl- 个数为1NA |
M2O3中M元素的化合价为( )
| A、+3 | B、+5 | C、+4 | D、+6 |
下列物质与水混合后静置,出现分层的是( )
| A、乙酸乙酯 | B、乙酸 |
| C、苯 | D、四氯化碳 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
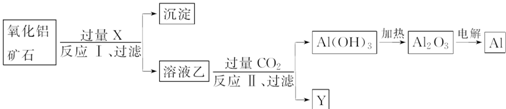
下列说法正确的是( )

下列说法正确的是( )
A、反应Ⅱ为CO2+2AlO
| ||
| B、CO2可以用H2SO4溶液或稀盐酸代替 | ||
| C、制取的铝单质与少量NaOH溶液反应的离子方程式为:Al+3OH-=Al(OH)3↓ | ||
| D、试剂X可以为NaOH溶液,沉淀中含有铁的化合物 |
叠氮酸(HN3)与醋酸酸性相似,下列叙述中正确的是( )
| A、HN3水溶液中微粒浓度大小顺序为:C(HN3)>C(H+)>C(N3-)>C(OH-) |
| B、HN3水溶液中微粒浓度大小顺序为:C(H+)>C(HN3)>C(N3-)>C(OH-) |
| C、NaN3水溶液中离子浓度大小顺序为:C(Na+)>C(N3-)>C(H+)>C(OH-) |
| D、HN3与NH3作用生成的产物是共价化合物 |
为保护环境、防止污染,下列最理想的燃料是( )
| A、酒精 | B、氢气 | C、汽油 | D、无烟煤 |
以下有关物质用途的叙述错误的是( )
| A、明矾:净水剂 |
| B、四氯化碳:灭火剂 |
| C、四氧化三铁:红色颜料 |
| D、小苏打:治胃酸过多 |