题目内容
7.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一 段时间,以下叙述正确的是( )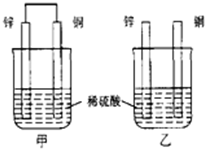
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 甲中电子从锌片流出,经导线流入铜片 | |
| D. | 产生气泡的速度甲比乙慢 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,则乙中锌片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中形成铜锌原电池,锌作负极,铜作正极,所以电子从锌片流出,经导线流入铜片,故C正确;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;
故选C.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
2.10mL 0.1mol/L KI与10mL 0.05mol/L AgNO3溶液混合制得AgI溶胶,用下述电解质使该溶胶聚沉,聚沉能力最大的是( )
| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
18.下列反应一定是氧化还原反应的是( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
15.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业上合成氨采用铁触媒作催化剂加快反应速率 | |
| B. | 啤酒瓶打开瓶盖产生大量气泡 | |
| C. | 加热蒸发MgCl2溶液得到Mg(OH)2 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
12.重水(D2O)的离子积c(D+)•c(OD-)=1.6×10-15,可以同pH一样的定义来规定pD=-lg{c(D+)}.下列关于pD的叙述不正确的是( )
| A. | 中性溶液中pD=8-lg4 | |
| B. | 含有0.01 mol NaOD的D2O溶液1 L,pD=12.0 | |
| C. | 溶解0.01 mol DCl的D2O溶液1 L,pD=12.0 | |
| D. | 在100 mL 0.25 mol/L的DCl重水溶液中,加入50 mL 0.20 mol/L NaOD重水溶液,pD=1.0 |