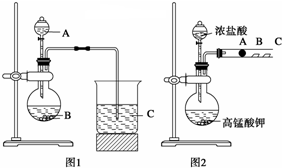
题目内容
9.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )| A. | 酸性高锰酸钾溶液、溴水 | B. | 酸性高锰酸钾溶液、碳酸钠溶液 | ||
| C. | 酸性高锰酸钾溶液、氢氧化钠溶液 | D. | 酸性高锰酸钾溶液、氯化钠溶液 |
分析 己烯、甲苯可被高锰酸钾氧化,己烯与溴水发生加成反应,苯酚与溴水反应生成白色沉淀,以此来解答.
解答 解:鉴别己烯、甲苯、乙酸乙酯、苯酚溶液,先利用高锰酸钾分成两组,使高锰酸钾溶液褪色的为己烯、甲苯,不反应的为乙酸乙酯、苯酚溶液,
然后分别与溴水反应,
己烯、甲苯中,使溴水褪色的为己烯,不反应的为甲苯;
乙酸乙酯、苯酚溶液中,与溴水反应生成白色沉淀的为苯酚,不反应的为乙酸乙酯,
故选A.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、性质差异及反应与现象为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.

练习册系列答案
相关题目
20.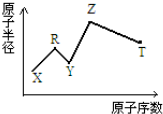 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 简单的气态氢化物的沸点和稳定性排序均为:Y>T | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
17.2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)是制备硫酸的重要反应.下列叙述中,正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
14.几种短周期元素的原子半径及主要化合价见下表:下列叙述不正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、M的单质在相同条件下与相同浓度稀盐酸反应的反应速率为L>M | |
| B. | M与T形成的化合物有两性 | |
| C. | Q是硫元素 | |
| D. | L、Q形成的简单离子核外电子数相等 |
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1mol${\;}_{\;}^{16}$OD-离子含有的电子、中子数均为1.0NA | |
| B. | 标准状况下,4.48L己烷含有的分子数为0.2NA | |
| C. | 总质量为5.6g的CaO和CaC2混合物中,所含离子总数小于0.2NA | |
| D. | 常温常压下,0.1molNH3与0.1molHCl充分反应后所得产物含0.1NA个分子 |